
| | 实验操作 | 预期现象 | 结 论 |
| 验证猜想Ⅰ | 步骤①:取少量0.01 mol/L 酸性KMnO4溶液,滴入所得溶液中 | | |
| 步骤②: | | 含有Fe3+ | |
| 验证猜想Ⅱ | 将所得气体通入如下装置 | | 含有两种或以上气体 |
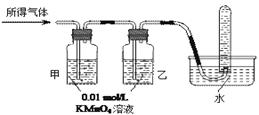
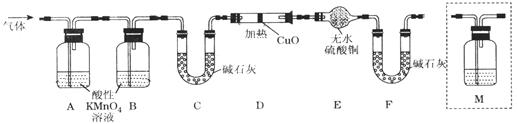
 CO2↑+2SO2↑+2H2O;②Q为二氧化碳,二氧化碳和二氧化硫都能使澄清石灰水变浑浊,选择a或b受二氧化硫的影响无法判断二氧化碳的存在,选d时二氧化碳被碱石灰吸收,答案为:澄清的石灰水,C;③根据氢气的性质分析,氢气具有还原性,能还原黑色的氧化铜而生成水,水能使白色的无水硫酸铜变蓝。答案为:确认是否有H2。
CO2↑+2SO2↑+2H2O;②Q为二氧化碳,二氧化碳和二氧化硫都能使澄清石灰水变浑浊,选择a或b受二氧化硫的影响无法判断二氧化碳的存在,选d时二氧化碳被碱石灰吸收,答案为:澄清的石灰水,C;③根据氢气的性质分析,氢气具有还原性,能还原黑色的氧化铜而生成水,水能使白色的无水硫酸铜变蓝。答案为:确认是否有H2。

科目:高中化学 来源:不详 题型:单选题
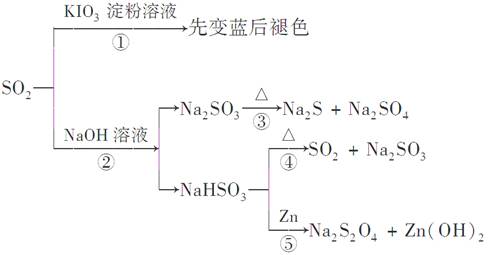
| A.反应①说明SO2具有漂白性,反应②说明SO2具有酸性 |
| B.反应②中生成物n(Na2SO3):n(NaHSO3)=1:1时,则反应物n(SO2):n(NaOH)=1:2 |
| C.反应③④⑤均属于氧化还原反应 |
| D.工业上可利用反应②和反应④回收SO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
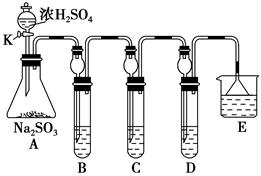
| 实验操作 | 预期现象和结论 |
| 将D中沉淀过滤,洗涤干净备用 | |
| 用另一干净试管取少量沉淀样品,加入______________ | _________________________ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
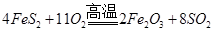
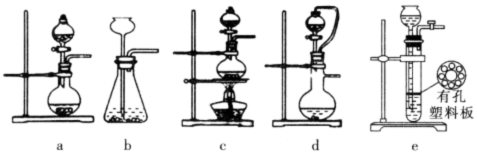
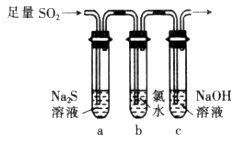
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.有机物不导电 | B.金刚石是自然界最硬的物质 |
| C.SO2可用作食品防腐剂 | D.NO可用于某些疾病的治疗 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
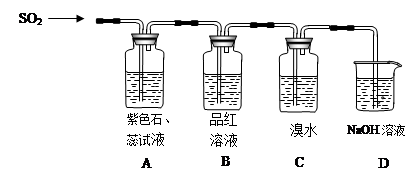
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铜片溶解,生成物冷却后加水稀释溶液成蓝色 |
| B.生成的气体体积为1.12L |
| C.参加反应的硫酸与被还原的硫酸物质的量之比为2:1 |
| D.该实验中可用Na2CO3溶液处理尾气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
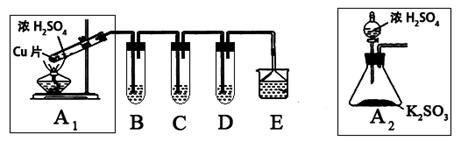
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1mol/L BaCl2溶液向小烧杯滴加直至过量。 | 若出现白色浑浊,则溶液中存在SO32-或 SO42-。 |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体 ___________________________________________________ | _________________________ ______________________________________________ |
| 步骤3:_______ _______________________ ___________________________________________________ | _________________________ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com