
【题目】研究CO2的利用对促进低碳社会的构建具有重要的意义。
(I) 将CO2与焦炭作用生成CO,CO可用于炼铁等。
①已知:Fe2O3(s) + 3C(石墨) ![]() 2Fe(s) + 3CO(g) △H 1 =+489 kJ·mol-1
2Fe(s) + 3CO(g) △H 1 =+489 kJ·mol-1
C(石墨) +CO2 (g) ![]() 2CO(g) △H 2 = +172 kJ·mol-1
2CO(g) △H 2 = +172 kJ·mol-1
则Fe2O3(s) + 3CO(g) ![]() 2Fe (s) + 3CO2(g) △H=_________。
2Fe (s) + 3CO2(g) △H=_________。
②利用燃烧反应可设计成CO/O2燃料电池(以H2SO4溶液为电解质溶液),写出该电池的正极反式_________。
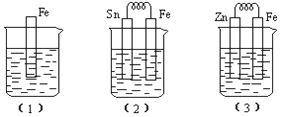
(II)如图所示,烧杯中都盛有稀硫酸。(1)中反应的离子方程式为______;比较(1)、(2)、(3)中纯铁被腐蚀的速率由快到慢的顺序是_____(用序号表示) 。
【答案】 -27KJ/mol O2 + 4H+ + 4e- =2H2O Fe + 2H+=Fe2+ +H2↑ ⑵>⑴>⑶
【解析】试题解析:(I)(1)①将两热化学方程式分别编号为a、b,依据盖斯定律a-b×3得到:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5KJ/mol,故答案为:△H=-28.5KJ/mol;②CO-O2酸性燃料电池放电时,正极上氧气被还原,电极反应式为:O2+4H++4e-=2H2O;(II)装置(1)中铁和稀硫酸反应置换反应,离子方程式为Fe+2H+==Fe2++H2↑;装置(2)是原电池,铁比锡活泼,做负极被腐蚀,比(1)中腐蚀速率快;装置(3)中锌比铁活泼,所以锌是负极,铁是正极,因此被腐蚀的是锌,故三个装置中纯铁被腐蚀的速率由快到慢的顺序是(2)>(1)>(3)。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】下列物质的沸点逐渐升高的是
A. NH3 PH3 AsH3 SbH3B. CH4 SiH4 GeH4 SnH4
C. CI4 CBr4 CF4 CCl4D. HF HCl HBr HI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是
A. 澄清的石灰水跟盐酸反应:H++OH-= H2O
B. 氯气与水反应:Cl2+H2O = 2H++Cl-+ClO-
C. 碳酸钡与稀盐酸反应:CO32-+2H+ = H2O+CO2↑
D. 金属钠跟水反应:Na+H2O = Na++OH-+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应CaCO3=CaO +CO2↑为非自发反应,要使此反应能发生,采取的措施( )
A. 升高温度B. 降低温度C. 减少CO2D. 增加CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若用乙炔作为有机合成的原料时,下列过程可能生成产物为CH2Br—CHBrCl的是( )
A.加HCl再加Br2 B.加HCl再加HBr
C.加Cl2再加HBr D.加Cl2再加Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于钠的叙述中,正确的是( )
A.钠放在空气中易被氧气氧化为过氧化钠,因此应保存在水面下
B.钠是强还原剂,它能从溶液中置换出金属活动性顺序表中钠后面的金属
C.直接观察,钠的焰色反应呈黄色
D.金属钠着火时,能用水来灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,1 mol X和n mol Y在体积为2 L的密闭容器中发生如下反应:X(g)+Y(g)![]() 2Z(g)+M(s),5 min后达到平衡,此时生成2a mol Z。下列说法正确的是
2Z(g)+M(s),5 min后达到平衡,此时生成2a mol Z。下列说法正确的是
A. 用X表示此反应的反应速率是(0.1-2a) mol·L-1·min-1
B. 当混合气体的质量不再发生变化时,说明反应达到平衡状态
C. 向平衡后的体系中加入1 mol M,平衡向逆反应方向移动
D. 向上述平衡体系中再充入1 mol X,v正增大,v逆减小,平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaCl2和NaCl组成的混合溶液中,c(Ca2+): c(Na+)=1 : 2,若该溶液中共有6mol Cl-,则混合溶液中NaCl的物质的量为( )
A.1molB.2molC.3molD.4mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com