
常温下,向10mL 0.1mol•L﹣1NaOH溶液中逐滴加入0.1mol•L﹣1醋酸溶液,所得滴定曲线如图所示.下列说法正确的是()

A. pH=7时,所加醋酸溶液的体积为10mL
B. pH<7时,溶液中:c(CH3COO﹣)>c(Na+)
C. 7<pH<13时,溶液中:c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+)
D. 继续滴加0.1 mol•L﹣1醋酸溶液,溶液pH可以变为1
考点: 中和滴定.
专题: 电离平衡与溶液的pH专题.
分析: A、醋酸钠是强碱弱酸盐,其水溶液呈碱性,若要使溶液呈中性,酸的物质的量应稍微大些
B、根据溶液呈电中性,溶液中阴阳离子所带电荷相等.
C、根据溶液中电荷守恒和溶液的酸碱性判断各种离子浓度相对大小.
D、根据醋酸是若电解质,不可能完全电离;
解答: 解:A、醋酸钠是强碱弱酸盐其水溶液呈碱性,要使溶液呈中性,所以醋酸溶液的体积为大于10mL,故A错误;
B、溶液中阴阳离子所带电荷相等,即c(Na+)+c(H+)=c(CH3COO﹣)+(OH﹣),pH<7时,c(H+)>(OH﹣),所以
即c(CH3COO﹣)>c(Na+),故B正确;
C、7<pH<13时,溶液呈碱性,溶液中氢氧根离子浓度大于氢离子浓度,根据溶液中电荷守恒知,溶液中醋酸根离子浓度小于钠离子浓度,但醋酸根离子浓度和氢氧根离子浓度无法比较大小,故C错误;
D、醋酸是若电解质,不可能完全电离,所以溶液pH不可以变为1,故D错误;
故选:B.
点评: 本题考查了溶液酸碱性判断、溶液离子浓度的大小比较,本题难度中等,会根据电荷守恒解本题的关键.


科目:高中化学 来源: 题型:
下列热化学方程式书写正确的是( )
|
| A. | 2SO2+O2=2SO3 △H=﹣196.6kJ•mol﹣1 |
|
| B. | H2(g)+ |
|
| C. | 2H2(g)+O2(g)=2H2O(l)△H=﹣571.6kJ |
|
| D. | C(s)+O2(g)=CO2(g)△H=+393.5kJ•mol﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
同温同压下,同体积的氨气和硫化氢气体(H2S)的质量比为 ;同质量的氨和硫化氢气体的体积比为 ,其中含有的氢的原子个数比为 ;若二者氢原子数相等,它们的体积比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
某烃的分子式为C11H20,1mol该烃在催化剂作用下可以吸收2mol H2;用酸性KMnO4溶液氧化,得到丁酮(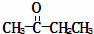 )、丙酮(
)、丙酮(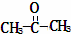 )和琥珀酸(
)和琥珀酸( )三者的混合物.该烃的结构简式为()
)三者的混合物.该烃的结构简式为()
A. 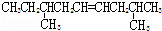 B.
B.  C.
C. 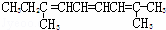 D.
D. 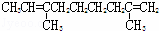
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下面的反应路线及所给信息填空:

(1)A的结构简式是 ,名称是 ;
(2)填写以下反应的反应类型:① ;② ;③ ;
(3)反应④的反应试剂及反应条件 ;
(4)反应②的化学方程式为 ;B水解的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
纯碱是工业生产和日常生活中的重要物质.某兴趣小组为测定某工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数,设计了下列三种实验方案进行探究.请填空:
方案一:纯碱样品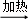 测定剩余固体质量
测定剩余固体质量
(1)分别称取干燥坩埚和纯碱样品的质量,将纯碱样品放入坩埚中充分加热(如右图).坩埚中发生反应的化学方程式为: .
(2)将坩埚置于干燥器中冷却后称量.实验时需要重复“加热、冷却、称量”操作多次,其目的是: .
方案二:纯碱样品溶液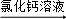 测定沉淀质量
测定沉淀质量
(1)称取m1g样品,置于小烧杯中,加水溶解.向小烧杯中滴加足量氯化钙溶液(如图).将反应混和物过滤后的下一步操作是: .
(2)沉淀经干燥后称量为m2g,则该样品中碳酸钠的质量分数为: %.
(3)如果用氢氧化钙溶液代替氯化钙溶液作沉淀剂,在其他操作正确的情况下,测得样品中的碳酸钠质量分数将比实际 (填“偏高”、“偏低”或“不变”).
方案三:纯碱样品 测定生成二氧化碳的质量
测定生成二氧化碳的质量
(1)本实验采用vk图装置,C中盛放的物质是 .
(2)反应前后都要通入N2,反应后通入N2的目的是: 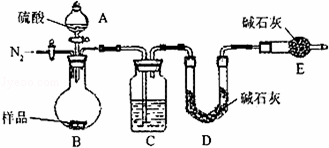

查看答案和解析>>
科目:高中化学 来源: 题型:
NaCl是一种化工原料,可以制备一系列物质(见图4)。下列说法正确的是

A.25℃,NaHCO3在水中的溶解度比Na2CO3的大
B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂
C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应
D.图4所示转化反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
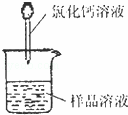
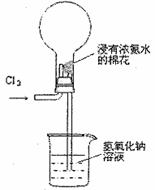
右图是模拟氯碱工业生产中检查氯气是否泄漏的装置,下列有关说法错误的是
A.烧瓶中立即出现白烟
B.烧瓶中立即出现红棕色
C.烧瓶中发生的反应表明常温下氨气有还原性
D.烧杯中的溶液是为了吸收有害气体
查看答案和解析>>
科目:高中化学 来源: 题型:
研究发现,空气中少量的NO2能参与硫酸型酸雨的形成,反应过程如下:
 ①SO2+NO2
①SO2+NO2 SO3+NO
SO3+NO
②SO3+H2O H2SO4
H2SO4
③2NO+O2 2NO2
2NO2
NO2在上述过程中的作用,与H2SO4在下述变化中的作用相似的是( )
A.潮湿的氯气通过盛有浓H2SO4的洗气瓶 B.硫化氢通入浓H2SO4中
C.浓H2SO4滴入萤石中,加热 D.加入少量H2SO4使乙酸乙酯水解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com