
已知:①1 g氢气在氧气中完全燃烧生成气态水,放出热量120.9 kJ,②中和热为57.3 kJ·mol-1,③C(石墨s)=C(金刚石s) ΔH=+1.90 kJ·mol-1,下列说法正确的是( )。
| A.氢气的燃烧热为241.8 kJ·mol-1 |
| B.氢气燃烧的热化学方程式:2H2+O2=2H2O ΔH=-483.6 kJ·mol-1 |
| C.盐酸和氨水混合的热化学方程式:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1 |
| D.由③可知金刚石不及石墨稳定 |
科目:高中化学 来源: 题型:单选题
下列关于反应热的说法正确的是
| A.当△H<O时,表示该反应为吸热反应 |
B.已知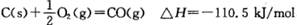 ,说明碳的燃烧热为110kJ/mol ,说明碳的燃烧热为110kJ/mol |
| C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 |
| D.化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知下列热化学方程式:Zn(s) + 1/2 O2(g)= ZnO(s) △H1;Hg(l) + 1/2 O2(g)=HgO(s) △H2;
则 Zn(s)+ HgO(s)=Hg(l)+ ZnO(s),△H值为
| A.△H2-△H1 | B.△H2+△H1 | C.△H1-△H2 | D.-△H1-△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列各图有关量的变化趋势中错误的是
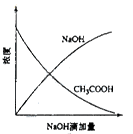
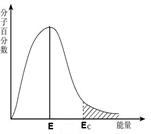
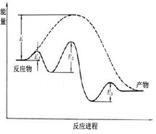
A B C D
| A.图A为向盐酸中滴加NaOH发生中和反应过程中溶液温度的变化趋势 |
| B.图B为向醋酸中滴加NaOH发生中和反应过程中各物质浓度的变化趋势 |
| C.图C中能量≥Ec的分子称为活化分子,E为分子平均能量,则活化能为Ec-E |
| D.图D为未加入催化剂和加入催化剂的反应进程中的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在298 K、1.01×105 Pa下,将32 g SO2通入750 mL 1 mol/L KOH溶液中充分反应。测得反应放出x kJ的热量。已知在该条件下,1 mol SO2通入1 L 2 mol/L KOH溶液中充分反应放出y kJ的热量。则SO2与KOH溶液反应生成KHSO3的热化学方程式正确的是( )
| A.SO2(g)+KOH(aq)=KHSO3(aq)ΔH="-(4x-y)" kJ/mol |
| B.SO2(g)+KOH(aq)=KHSO3(aq)ΔH="-(2x-y)" kJ/mol |
| C.SO2(g)+KOH(aq)=KHSO3(aq)ΔH="-(2y-x)" kJ/mol |
| D.2SO2(g)+2KOH(l)=2KHSO3(l)ΔH="-(8x-2y)" kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
25 ℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ·mol-1、285.8 kJ·mol-1、890.3 kJ·mol-1、2 800 kJ·mol-1,则下列热化学方程式正确的是( )。
A.C(s)+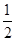 O2(g)=CO(g)ΔH=-393.5 kJ·mol-1 O2(g)=CO(g)ΔH=-393.5 kJ·mol-1 |
| B.2H2(g)+O2(g)=2H2O(g)ΔH=+571.6 kJ·mol-1 |
| C.CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-890.3 kJ·mol-1 |
D.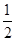 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)ΔH=-1 400 kJ·mol-1 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)ΔH=-1 400 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示。已知断裂1 mol化学键所需的能量(kJ):NN为942、OO为500、NN为154,则断裂1 mol NH键所需的能量(kJ)是( )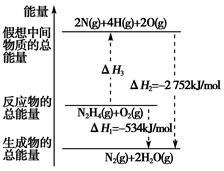
| A.194 | B.391 | C.516 | D.658 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列图示与对应的叙述相符的是( )。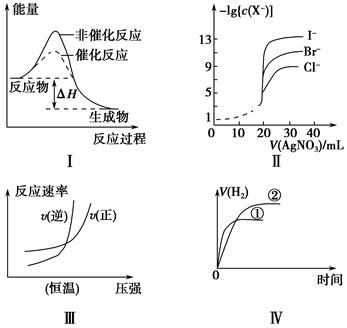
| A.图Ⅰ中ΔH表示某一反应有无催化剂的反应热相同 |
| B.用0.010 0 mol·L-1硝酸银标准溶液,滴定浓度均为0.100 0 mol·L-1 Cl-、Br-及I-的混合溶液,由图Ⅱ曲线,可确定首先沉淀的是Cl- |
| C.图Ⅲ可表示工业合成氨反应在温度一定的情况下反应速率与压强的关系 |
| D.图Ⅳ表示相同体积、相同pH的一元强酸溶液①和一元弱酸溶液②分别与足量的锌粉发生反应,V(H2)随时间的变化曲线 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
25 ℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是ΔH=-393.5 kJ·mol-1、ΔH=-285.8 kJ·mol-1、ΔH=-890.3 kJmol-1、ΔH=-2 800 kJ·mol-1,则下列热化学方程式正确的是 ( )。
A.C(s)+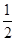 O2(g)===CO(g) ΔH=-393.5 kJ·mol-1 O2(g)===CO(g) ΔH=-393.5 kJ·mol-1 |
| B.2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1 |
| C.CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH=-890.3 kJ·mol-1 |
D.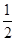 C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(g)ΔH=-1 400 kJ·mol-1 C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(g)ΔH=-1 400 kJ·mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com