
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2= Na2S2O5。

(1)装置Ⅰ中产生气体的化学方程式为______________________________。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是________。
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。

实验二 焦亚硫酸钠的性质
已知:Na2S2O5溶于水即生成NaHSO3。
(4)检测Na2S2O5晶体在空气中已被氧化的实验方案是 ____________________。
【答案】 Na2SO3+H2SO4=Na2SO4+SO2↑+H2O 过滤 d 取少量Na2S2O5晶体于试管中,加适量水溶解,滴加足量的盐酸,振荡,再滴入氯化钡溶液,有白色沉淀生成
【解析】(1)由装置Ⅱ中发生的反应可知,装置Ⅰ中产生的气体为SO2,亚硫酸钠与硫酸反应生成硫酸钠、二氧化硫与水,反应方程式为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;(2)装置Ⅱ中获得已析出的晶体,分离固体与液态,应采取过滤进行分离;(3)a.装置应将导管深入氨水中可以吸收二氧化硫,但为密闭环境,装置内压强增大易产生安全事故,a错误;b.该装置吸收二氧化硫能力较差,且为密闭环境,装置内压强增大易产生安全事故,b错误;c.该装置不能吸收二氧化硫,所以无法实现实验目的,c错误;d.该装置中氢氧化钠与二氧化硫反应,可以吸收,且防止倒吸,d正确;答案选d;(4)Na2S2O5中S元素的化合价为+4价,因此会被氧化为为+6价,即晶体在空气中易被氧化为Na2SO4,用盐酸、氯化钡溶液检验样品中是否含有硫酸根即可,实验方案为:取少量Na2S2O5晶体于试管中,加入适量水溶解,滴加盐酸,振荡,再滴加氯化钡溶液,有白色沉淀生成。


科目:高中化学 来源: 题型:
【题目】如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2是溶剂,反应原理是4Li+FeS2===Fe+2Li2S。下列说法不正确的是( )
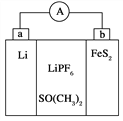
A. 可以用水代替SO(CH3)2做溶剂
B. 电子移动方向是由a极流向b极
C. 该装置将化学能转化为电能
D. b极反应式为FeS2+4Li++4e-===Fe+2Li2S
查看答案和解析>>
科目:高中化学 来源: 题型:
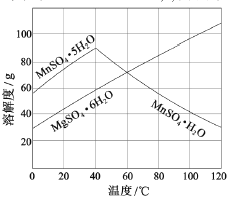
【题目】软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4·H2O ,反应的化学方程式为:MnO2+SO2=MnSO4
(1)质量为17.40g纯净MnO2最多能氧化_____L(标准状况)SO2。
(2)已知:Ksp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=3×10-39,pH=7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、Al3+(使其浓度小于1×10-6mol·L-1),需调节溶液pH范围为________。
(3)右图可以看出,从MnSO4和MgSO4混合溶液中结晶MnSO4·H2O晶体,需
控制结晶温度范围为_______。
(4)准确称取0.1710gMnSO4·H2O样品置于锥形瓶中,加入适量H2PO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+,用c(Fe2+)=0.0500mol·L-1的标准溶液滴定至终点(滴定过程中Mn3+被还原为Mn2+),消耗Fe2+溶液20.00mL。计算MnSO4·H2O样品的纯度(请给出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在醋酸的下列性质中,可以证明它是弱电解质的是 ( )
A. 1mol/L的醋酸溶液中H+浓度约为10-3mol/L B. 醋酸能与水以任意比互溶
C. 10mL 1mol/L的醋酸恰好与10mL 1mol/L NaOH溶液完全反应 D. 醋酸的导电性比强酸溶液弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa=lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。常温下,用0.1mol·L1NaOH溶液滴定20mL0.1mol·L1 H2SO3溶液的滴定曲线如下图所示(曲线上的数字为pH)。下列说法不正确的是( )
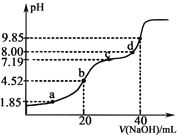
A. a点所得溶液中:2c(H2SO3)+c(SO32-)=0.1mol·L1
B. b点所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-)
C. c点所得溶液中:c(Na+)>3c(HSO3-)
D. d点所得溶液中:c(Na+)>c(SO32-)> c(HSO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
(1)该电池的正极反应式为 ,电池反应的离子方程式为:
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn g。(已经F=96500C/mol)(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过____分离回收;滤渣的主要成分是MnO2、______和 ,欲从中得到较纯的MnO2,最简便的方法是 ,其原理是 。
(4)用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为_____,加碱调节至pH为 时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为_____时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果是 ,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应无论怎样调整反应物的用量都只能生成一种物质的是
A.甲烷和氯气混合后光照发生反应 B.乙烯与氯化氢的加成反应
C.1,3—丁二烯与氢气发生反应 D.乙炔和氯气的加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图海水综合利用的工业流程图,判断下列说法正确的是( )
已知:MgCl26H2O受热生成Mg(OH)Cl和HCl气体等
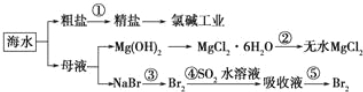
A.除去粗盐中杂质(Mg2+、SO42﹣、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B.在过程②中将MgCl26H2O灼烧即可制得无水MgCl2
C.从能量转换角度看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程
D.从第③步到第⑤步的目的是为了富集
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com