
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
| 醋酸浓度(mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
| 0.2000mol/L×0.02L |
| 0.02L |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 气体物质 | 主要来源 | 对环境的影响 | |
| A | 二氧化碳 | 化石燃料的燃烧 | 酸雨 |
| B | 二氧化硫 | 汽车尾气的排放 | 光化学烟雾 |
| C | 二氧化氮 | 工厂废气的排放 | 温室效应 |
| D | 甲醛 | 各类含酚醛树脂胶的人造板装饰材料 | 室内空气污染 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C2H6、C3H6、C4H6 |
| B、CH4、C2H4、C3H4 |
| C、C2H4、C3H6、C3H4 |
| D、CH4、C2H6、C3H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 方案 | 操作过程 | 现象和结论 |
| ① | ||
| ② | ||
| ③ | ||
| ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
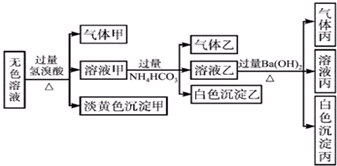 某无色溶液中可能含有离子:Na+、Ag+、Fe3+、Ba2+、Al3+、S2-、AlO2-、SO32-、SO42-,现取该溶液进行有关实验,实验结果如图所示:由该实验可知( )
某无色溶液中可能含有离子:Na+、Ag+、Fe3+、Ba2+、Al3+、S2-、AlO2-、SO32-、SO42-,现取该溶液进行有关实验,实验结果如图所示:由该实验可知( )| A、浅黄色沉淀甲可能为AgBr |
| B、由溶液甲生成沉淀乙的离子方程式为:Al3++3HCO3-═Al(OH)3+3CO2 |
| C、气体乙是NH3 |
| D、综合上述信息可以确定肯定存在的离子有:SO32-、S2-、Al3+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2g | B、14g |
| C、8g | D、10g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com