
| A. | 用托盘天平称取NaCl固体2.9 g | |
| B. | 胶头滴管加水定容时,有少量水滴到容量瓶外 | |
| C. | 定容时俯视读数 | |
| D. | 称量固体时,天平的两个托盘上放两张质量相等的纸片,其他操作均正确 |
分析 根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析.
解答 解:A、配制450mL 0.1mol•L-1的NaCl溶液需选用500mL容量瓶,则需要配制的是500mL0.1mol/L的NaCl溶液,则需要的氯化钠的物质的量n=CV=0.1mol/L×0.5L=0.05mol,质量m=nM=0.05mol×58.5g/mol=2.9g,故不会使溶液的浓度偏高,故A错误;
B、用胶头滴管定容时,有水滴到容量瓶外时,由于水中不含溶质,故对浓度无影响,故B错误;
C、定容时俯视读数,则溶液体积偏小,浓度偏高,故C正确;
D、称量氯化钠固体时应放到纸上称量,故应在天平的两个托盘上放两张质量相等的纸片,故对浓度无影响,故D错误.
故选C.
点评 本题考查了一定物质的量浓度溶液的配制过程中的误差分析,属于基础型题目,难度不大.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:HBr>HCl | B. | 碱性:Al(OH)3<Mg(OH)2 | ||
| C. | 氧化性:O<F | D. | 还原性:S2->O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PbO2为还原剂,具有还原性 | |
| B. | 氧化产物与还原产物的物质的量之比为5:2 | |
| C. | 生成1mol的Pb2+,转移的电子的物质的量为2mol | |
| D. | 酸性环境下MnO4-具有强氧化性,其氧化性强于PbO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中含有2mol K2SO4 | B. | 可将2mol K2SO4溶于1L水中制得 | ||
| C. | 溶液中c(K+ )=4 mol•L-1 | D. | 1L 溶液中含4molK+,4molSO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NA个H2与O2恰好反应,消耗氧气的体积约是22.4L | |
| B. | 1molC12与足量Fe反应,转移的电子数为3NA | |
| C. | 0.1molNaHSO4固体中,共含有0.2 NA个离子 | |
| D. | 在标准状况下,lLpH=13的NaOH溶液中,含有0.1NA个OH-(不考虑水的电离) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
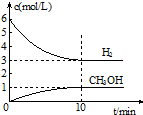 T℃时,在1L的密闭容器中充入2mol CO2和6mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.测得H2和CH3OH(g)的浓度随时间变化情况如图所示:下列说法不正确的是( )
T℃时,在1L的密闭容器中充入2mol CO2和6mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.测得H2和CH3OH(g)的浓度随时间变化情况如图所示:下列说法不正确的是( )| A. | 0~10min内v(H2)=0.3 mol•L-1•min-1 | |
| B. | T℃时,平衡常数K=$\frac{1}{27}$,CO2与H2的转化率相等 | |
| C. | T℃时,当有32 g CH3OH生成时,放出49.0 kJ的热量 | |
| D. | 达到平衡后,升高温度或再充入CO2气体,都可以提高H2的转化率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com