��2012?����ģ�⣩��Դ��ȱ���������ٵ��ش����⣮�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ������˼״�����Ϊ21���͵�����ȼ�ϣ�
��1����֪�ڳ��³�ѹ�£�
��2CH
3OH��l��+3O
2��g���T2CO
2��g��+4H
2O��g����H=
_1275.6kJ?mol
-1��H
2O��l���TH
2O��g����H=+44.0kJ��mol
-1д����ʾ�״�ȼ���ȵ��Ȼ�ѧ����ʽ��
CH
3OH��g��+
O
2��g��=CO
2��g��+2H
2O��l����H=-725.8kJ/mol
CH
3OH��g��+
O
2��g��=CO
2��g��+2H
2O��l����H=-725.8kJ/mol
��
��2����ҵ��һ������������ַ�Ӧ�ϳɼ״���
��ӦA��CO
2��g��+3H
2��g��?CH
3OH��g��+H
2O��g����H
1��ӦB��CO��g��+2H
2��g��?CH
3OH��g����H
2ȡ��ݵ����CO
2��H
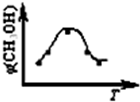
2�Ļ�����壨���ʵ���֮�Ⱦ�Ϊ1��3�����ֱ�����¶Ȳ�ͬ���ݻ���ͬ�ĺ����ܱ������У�����������Ӧ����Ӧ��ͬʱ���ü״�����������գ�CH
3OH�� �뷴Ӧ�¶�T�Ĺ�ϵ������ͼ��ʾ��������CO
2ת��Ϊ�״��ķ�Ӧ�ġ�H
1��
��
0�����������������=������
�ڶ��ڷ�ӦA���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ���
BD
BD
��
A�������¶� B������CO
2����
C������He��ʹ��ϵ��ѹǿ���� D����ԭ�����ٳ���CO
2��H
2��ij�¶��£���4mol CO��12mol H
2������2L���ܱ������У���ַ�Ӧ���ﵽƽ����c��CO��=0.5mol?L
-1������¶��¸÷�Ӧ��ƽ�ⳣ��Ϊ
0.33
0.33
��
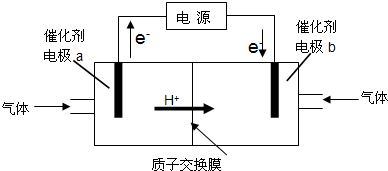
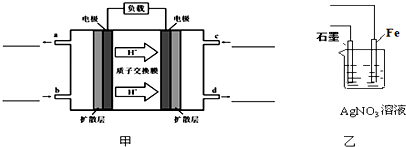
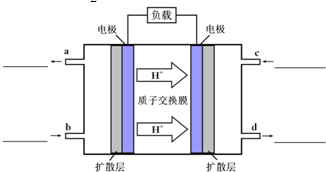
�ܣ�ij�ּ״�-����ȼ�ϵ���Dz��ò���Ϊ�缫��ϡ�������������Һ���乤��ʱ�����ĵ缫��Ӧʽ�ɱ�ʾΪ
CH3OH-6e-+H2O=6H++CO2��
CH3OH-6e-+H2O=6H++CO2��
��3����ȼú�����е�SO
2��NO
2�����ʵ���֮��Ϊ1��1����һ�����İ�����������Ӧ����������狀�����淋Ļ������Ϊ����Ʒ���ʣ���÷�Ӧ�Ļ�ѧ����ʽΪ
12NH3+3O2+4SO2+4NO2+6H2O=4��NH4��2SO4+4NH4NO3
12NH3+3O2+4SO2+4NO2+6H2O=4��NH4��2SO4+4NH4NO3
��
��4����һ�����ʵ���Ũ�ȵ��������Һ�еμ�������NaOH��Һ��ʹ��Һ��pH=7������Һ��c��Na
+��+c��H
+��
��
��
c��NO
3-��+c��OH
-�������������=��������



 ӥ�ɽ̸��νӽ̲ĺӱ�����������ϵ�д�
ӥ�ɽ̸��νӽ̲ĺӱ�����������ϵ�д�
 ��2012?����ģ�⣩��Դ��ȱ���������ٵ��ش����⣮�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ������˼״�����Ϊ21���͵�����ȼ�ϣ�
��2012?����ģ�⣩��Դ��ȱ���������ٵ��ش����⣮�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ������˼״�����Ϊ21���͵�����ȼ�ϣ�