
【题目】已知在150℃时,NO2按下式发生分解反应2NO2![]() 2NO+O2 △H>0。向容积为1L的密闭容器中加入0.05molNO2在150℃时充分反应,达到平衡后测得c(NO)=0.04mol/L,吸收热量akJ。
2NO+O2 △H>0。向容积为1L的密闭容器中加入0.05molNO2在150℃时充分反应,达到平衡后测得c(NO)=0.04mol/L,吸收热量akJ。
(1)能说明上述反应已经达到化学平衡状态的是 。
A.容器内气体的颜色不再变化
B.容器内压强不再变化
C.容器内气体的密度不再变化
D.容器内气体的平均摩尔质量不再变化
E.v逆(NO2)=v正(NO)
F.相同时间内每消耗2个NO2分子的同时,生成2个NO分子
(2)下列有关该反应的图像中正确的是 。




(3)若从反应开始至c(NO)=0.04mol/L共耗时5分钟,则用O2表示的平均反应速率为 。
(4)150℃时上述反应的平衡常数数值为 (可不写单位)。
(5)若在相同的容器内开始时只加入0.05molNO和0.025molO2,在相同的温度下充分反应达到平衡后,恰好放出akJ的热量,则此时O2的转化率为 。
(6)恒容条件下,下列措施中能使n(NO2)/ n(NO)增大的有 。
A.降低温度 B.充入He气
C.再充入1 mol NO (g)和0.5 mol O2(g) D.使用催化剂
【答案】
(1)ABDE
(2)AD
(3)0.004mol/(L·min)
(4)0.32mol/L
(5)20%
(6)AC
【解析】
试题分析:
(1)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。A.颜色深浅和NO2浓度有关系,当容器内气体的颜色不再变化,说明NO2浓度不变,反应达到化学平衡状态;B.反应2NO2![]() 2NO+O2为正反应方向气体系数增大的反应,当容器内压强不再变化,说明反应体系中各种物质的浓度不再发生变化,反应达到化学平衡状态;C.密度=质量÷体积,恒容密闭容器中,质量不变,体积也不变,则密度一直不变,所以当容器内气体的密度不再变化,不能说明反应达到化学平衡状态;D.混合气体的平均摩尔质量=混合气体的质量÷混合气体的总物质的量,质量不变,总物质的量变化,所以当容器内气体的平均摩尔质量不再变化时,说明反应达到化学平衡状态;E.v逆(NO2)=v正(NO),说明反应达到化学平衡状态;F.相同时间内每消耗2个NO2分子的同时,生成2个NO分子,都表示的是正反应速率,不能说明反应达到化学平衡状态;故选ABDE。
2NO+O2为正反应方向气体系数增大的反应,当容器内压强不再变化,说明反应体系中各种物质的浓度不再发生变化,反应达到化学平衡状态;C.密度=质量÷体积,恒容密闭容器中,质量不变,体积也不变,则密度一直不变,所以当容器内气体的密度不再变化,不能说明反应达到化学平衡状态;D.混合气体的平均摩尔质量=混合气体的质量÷混合气体的总物质的量,质量不变,总物质的量变化,所以当容器内气体的平均摩尔质量不再变化时,说明反应达到化学平衡状态;E.v逆(NO2)=v正(NO),说明反应达到化学平衡状态;F.相同时间内每消耗2个NO2分子的同时,生成2个NO分子,都表示的是正反应速率,不能说明反应达到化学平衡状态;故选ABDE。
(2)反应2NO2![]() 2NO+O2为正反应方向气体系数增大的吸热反应。A.升高温度,v逆、v正都增大,平衡正向移动,故A正确;B.升高温度,平衡正向移动,NO2转化率增大。压强增大,平衡逆向移动,NO2转化率减小,故B错误;C.升高温度,平衡正向移动,NO%增大。压强增大,平衡逆向移动,NO%减小,故C错误;D.根据先拐先平,可知T1>T2,升高温度,平衡正向移动,c(NO)增大,故D正确。故选AD。
2NO+O2为正反应方向气体系数增大的吸热反应。A.升高温度,v逆、v正都增大,平衡正向移动,故A正确;B.升高温度,平衡正向移动,NO2转化率增大。压强增大,平衡逆向移动,NO2转化率减小,故B错误;C.升高温度,平衡正向移动,NO%增大。压强增大,平衡逆向移动,NO%减小,故C错误;D.根据先拐先平,可知T1>T2,升高温度,平衡正向移动,c(NO)增大,故D正确。故选AD。
(3)反应开始至c(NO)=0.04mol/L共耗时5分钟,则v(NO)=0.04mol/L÷5min=0.008mol/(L·min),化学反应速率之比等于方程式的系数之比,则用O2表示的平均反应速率v(O2)为0.004mol/(L·min)。
(4)容积为1L的密闭容器中加入0.05molNO2在150℃时发生反应2NO2![]() 2NO+O2,达到平衡后测得c(NO)=0.04mol/L,则平衡时c(NO2)=0.01mol/L,c(O2)=0.02mol/L,则平衡常数K=
2NO+O2,达到平衡后测得c(NO)=0.04mol/L,则平衡时c(NO2)=0.01mol/L,c(O2)=0.02mol/L,则平衡常数K=![]() =
=![]() =0.32mol/L。
=0.32mol/L。
(5)在相同的容器内,相同的温度下加入“0.05molNO和0.025molO2”和加入“0.05molNO2”互为等效平衡,则平衡时O2的物质的量为0.02mol,此时O2的转化率为(0.025mol-0.02mol)÷0.025molO2×100%=20%。
(6)A.降低温度,平衡逆向移动,n(NO2)增大,n(NO)减小,则n(NO2)/n(NO)增大;B.充入He气,平衡不移动,则n(NO2)/n(NO)不变;C.再充入1 mol NO (g)和0.5 mol O2(g),相当于增大压强,平衡逆向移动,则n(NO2)/n(NO)增大;D.使用催化剂,平衡不移动,则n(NO2)/n(NO)不变;故选AC。


科目:高中化学 来源: 题型:
【题目】已知某温度下CH3COOH的电离常数K=1.6×10-5。该温度下,向20ml 0.01mol/L CH3COOH溶液在逐滴加入0.01mol/L KOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:

(1)a点溶液中c(H+)为 ,pH约为 。
(2) a、b、c、d四点中水的电离程度最大的是 点,滴定过程中宜选用 作指示剂,滴定终点在 (填“c点以上”或“c点以下”)。
(3)下列操作中可能使所测CH3COOH溶液的浓度数值偏低的是 (填字母)。
A.酸式滴定管未用待测溶液润洗
B.锥形瓶用待测溶液润洗
C.放出酸液的滴定管开始有气泡,放出液体后气泡消失
D.碱式滴定管滴定前有气泡,滴定终点时气泡消失
E.碱式滴定管滴定前读数正确,滴定后俯视读数
(4)若向20ml稀氨水中逐滴加入等浓度的盐酸,下列变化趋势正确的是 (填序号).

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有4种混合溶液,分别由等体积0.1 mol·L-1的两种溶液混合而成:①NH4Cl与CH3COONa,②NH4Cl与HCl,③NH4Cl与NaCl,④NH4Cl与NH3·H2O。下列各项排序正确的是
A. pH:②<①<③<④ B. 溶液中c(H+):①<③<②<④
C. c(NH![]() ):①<③<②<④ D. c(NH3·H2O):①<③<④<②
):①<③<②<④ D. c(NH3·H2O):①<③<④<②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从下列事实所列出的相应结论正确的是 ( )
实 验 事 实 | 结 论 | |
A | Cl2的水溶液可以导电 | Cl2是电解质 |
B | SO2通入硝酸钡溶液出现白色沉淀 | BaSO3不溶于强酸 |
C | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 酸性:HCO3->HAlO2或Al(OH)3 |
D | SO2通入KMnO4溶液,溶液褪色 | SO2具有漂白性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]俗称莫尔盐,是浅绿色晶体,可溶于水,在100℃~110℃时分解,常用作定量分析中的标准试剂。某化学小组以废铁屑为原料在实验室中进行实验探究——制备硫酸亚铁铵并检验其纯度,过程如下:
I.制备硫酸亚铁铵
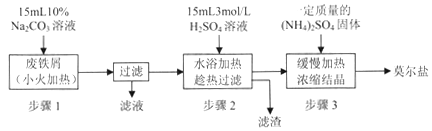
请回答下列问题:
(1)步骤l的作用是_________。(用离子方程式及必要的文字说明);
(2)步骤2中所加硫酸需过量,且不宜等到铁屑完全反应后才过滤,其中蕴含的道理是_______________;
II.测定硫酸亚铁铵的纯度
称取mg实验室制备的硫酸亚铁铵样品,配成500ml溶液,取25. 00mL硫酸亚铁按溶液,用0 . 1mol/L的酸性KMnO4溶液进行滴定,再重复滴定两次。
(3)配制(NH4)2SO4·FeSO4溶液所用的蒸馏水,通常需加热煮沸一段时间后,冷却至室温再使用,这样操作的好处是___________________;
(4)滴定时发生反应的离子方程式为___________________;
(5)滴定终点时的现象为 ___________________;
(6)三次滴定测得酸性KMnO4溶液的用量平均值为VmL,则硫酸亚铁铵样品的纯度为__________;
(7)化学小组分析发现这种检测纯度的方法不够准确,目前处理氮氧化物污染的方法有多种,请你帮助他们设计一种检测方案________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将过量SO2通入下列溶液中,最终能出现白色浑浊的是
①Ca(OH)2;②BaCl2;③NaAlO2;④Na2SiO3;⑤Ba(NO3)2;⑥苯酚钠;⑦Na2CO3
A. ①②④⑦ B. ②③⑥⑦ C. ④⑤⑥⑦ D. ③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将一定量的A、B气体充入密闭容器,发生反应:A(g)+B(g)![]() xC(?)+3D(?)。反应平衡后,改变影响平衡的一个条件,物质A的浓度变化如下图所示。下列有关说法正确的是
xC(?)+3D(?)。反应平衡后,改变影响平衡的一个条件,物质A的浓度变化如下图所示。下列有关说法正确的是
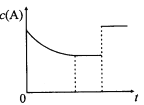
A.x=2,C为气态,D可能为气态也可能为非气态
B.改变的条件可能是使用了催化剂
C.其他条件不变,若向容器中加入少量C,A的平衡转化率不变
D.该反应的化学平衡常数K=[c(C)]2/c(A) ·c(B),且温度升高,K值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.NaOH溶液能导电,所以NaOH溶液是电解质
B.固体KC1不导电,但KC1是电解质
C.氯水能导电,所以Cl2是电解质
D.C02的水溶液能导电,所以C02是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应xA(g)+ yB(g)![]() zC(g)达平衡时,测得A的浓度为0.5mol/L,在温度不变的条件下,将容器的容积扩大到两倍后再达到平衡,A浓度降低为0.3mol/L,有关判断正确的是:
zC(g)达平衡时,测得A的浓度为0.5mol/L,在温度不变的条件下,将容器的容积扩大到两倍后再达到平衡,A浓度降低为0.3mol/L,有关判断正确的是:
A.x + y<z B.平衡向正反应方向移动
C.物质B的转化率增大 D.C的体积分数下降
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com