
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源:不详 题型:实验题
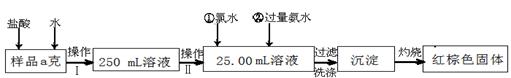
| A.50mL烧杯 | B.50mL量筒 | C.25mL碱式滴定管 | D.25mL酸式滴定管 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 向NaAlO2溶液中滴加饱和NaHCO3溶液,有白色沉淀产生 | 验证两者都发生了水解反应,且相互促进 |
| B | 苯酚溶液中加入几滴稀溴水没有白色沉淀出现 | 说明苯酚与溴没有发生反应 |
| C | 常温下白磷可自燃而氮气需要在放电时才与氧气反应 | 非金属性:P>N |
| D | 向相同体积、相同pH的两种一元酸中分别加入足量锌粉,测量产生氢气的体积 | 可以比较两种一元酸的酸性相对强弱 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
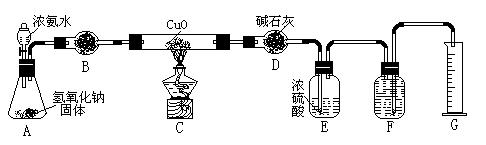
| A.碱石灰 | B.生石灰 | C.五氧化二磷 | D.氢氧化钠 |
 5)待实验完毕后,若实验测得N2的体积(折算成标准状况)a L,干燥管D增重b g, 则氨分子中氮、氢的原子个数比为(用含a、b字母的代数式表示) 。
5)待实验完毕后,若实验测得N2的体积(折算成标准状况)a L,干燥管D增重b g, 则氨分子中氮、氢的原子个数比为(用含a、b字母的代数式表示) 。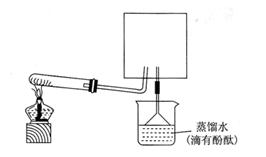
 。
。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
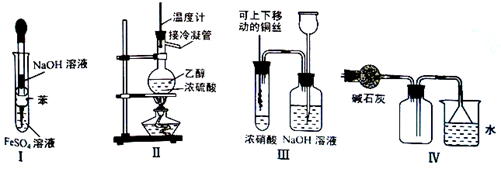
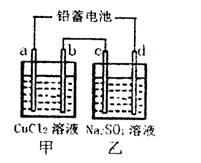
| A.利用Ⅰ制取Fe(OH)2 |
| B.利用Ⅱ装置制取C2H4 |
| C.利用Ⅲ装置进行铜与浓硝酸反应的实验 |
| D.利用Ⅳ装置收集NH3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
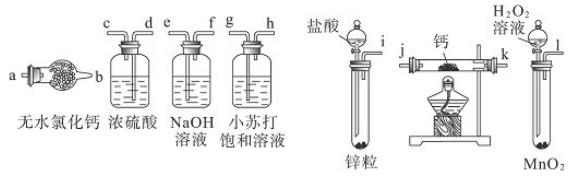
| A.加热反应一段时间 | B.收集气体并检验其纯度 |
| C.关闭分液漏斗活塞 | D.停止加热,充分冷却 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
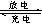 2PbSO4(s)+2H2O(1)。电解一段时间后,向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是______
2PbSO4(s)+2H2O(1)。电解一段时间后,向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是______ ______
______| A.d极为阴极 |
| B.若利用甲池精炼铜,b极应为粗铜 |
| C.放电时铅蓄电池负极的电极反应式为: PbO2(s)+4H+(aq)+ 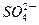 (aq)+4e- (aq)+4e- PbSO4(s)+2H2O(1) PbSO4(s)+2H2O(1) |
| D.若四个电极材料均为石墨,当析出6.4g Cu时,两池中共产生气体3.36L(标准 |
 H++A2-,请回答下列问题:
H++A2-,请回答下列问题: mol·L-1的NaHA溶液的pH=2,则0.1mol·L-1的H2A溶液中氢离子的物质的量浓度可能是__________0.1lmol·L-1(填“<”、“>”或“=”),理由是:___________________________.
mol·L-1的NaHA溶液的pH=2,则0.1mol·L-1的H2A溶液中氢离子的物质的量浓度可能是__________0.1lmol·L-1(填“<”、“>”或“=”),理由是:___________________________. CH3OH(g); △H=-90.8kJ·mol-1
CH3OH(g); △H=-90.8kJ·mol-1 CH3OH(g)
CH3OH(g) CH3OCH3(g)+H2O(g); △H=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g); △H=-23.5kJ·mol-1 CO2(g)+H2(g);△=-41.3kJ·mol-1
CO2(g)+H2(g);△=-41.3kJ·mol-1 2SO3(g)。在一定温度下,将0.23 mol SO2和0.11 mol氧气放入容积为l L的密闭容器中发生反应,达到平衡后得到0.12 mol SO3,则反应的平衡常数K=________。若温度不变,再加入0.50 mol氧气后重新达到平衡,则SO3的体积分数将___________(填“增大”、“不变”或“减小”)。
2SO3(g)。在一定温度下,将0.23 mol SO2和0.11 mol氧气放入容积为l L的密闭容器中发生反应,达到平衡后得到0.12 mol SO3,则反应的平衡常数K=________。若温度不变,再加入0.50 mol氧气后重新达到平衡,则SO3的体积分数将___________(填“增大”、“不变”或“减小”)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.NO(H2O含石蕊) | B.NH3(H2O含酚酞) | C.SO2 (NaOH溶液) | D.HCl(NaCl溶液) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2 / 3 mol·L-1 | B.1 / 33.6 mol·L-1 |
| C.1 / 22.4 mol·L-1 | D.不能确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com