
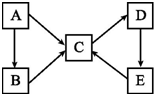
 A、B、C、D、E五种物质(或离子)均含有同一种元素,它们之间有如图所示的转化关系:
A、B、C、D、E五种物质(或离子)均含有同一种元素,它们之间有如图所示的转化关系:分析 (1)A为金属单质,C、D的相对分子质量相差16,0.05mol/L E溶液中只有3种离子,且溶液中的$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012,则溶液中的c(H+)=0.1mol/L,即E为二元强酸,则E为硫酸,根据转化关系可知,A为S,C为SO2,D为SO3,B为气体,应为H2S,E→C应为浓硫酸与铜的反应或浓硫酸与碳的反应,根据元素守恒书写化学方程式,A→C的反应为S(g)+O2(g)═SO2(g),每转移1mol e-就会放热143.5kJ,则转移4mol电子吸收143.5kJ×4=574.0kJ热量,以此书写热化学方程式;
(2)A为单质,B、C均属于盐类,D是一种白色沉淀,
①若B的水溶液呈酸性,C的水溶液呈碱性,则由转化关系可知A为Al,B为AlCl3,C为NaAlO2,D为Al(OH)3,B溶液呈酸性的原因是铝离子水解使溶液呈酸性;
②若B溶液呈黄色,与苯酚溶液混合后显紫色,可说明B中含有Fe3+,A应为Fe,C中含有Fe2+,E是一种不溶性碱,由转化关系可知D为Fe(OH)2,E为Fe(OH)3,若要实现Fe(OH)3到FeCl2的转化,应该加入还原性的酸氢碘酸(或HI);
(3)A-E均为化合物,A是淡黄色固体,A为Na2O2;B、C两溶液在等物质的量浓度时,C溶液的pH较小,B为Na2CO3,C为NaHCO3,电解D的水溶液是最重要的工业生产之一,D应为NaCl,D→E→C也是工业制备C的普遍方法,为侯氏制碱法,E为NaHCO3,A~E均为化合物,且均含有元素Y,则Y为Na,据此答题.
解答 解:(1)A为金属单质,C、D的相对分子质量相差16,0.05mol/L E溶液中只有3种离子,且且溶液中的$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012,则溶液中的c(H+)=0.1mol/L,则E为硫酸,所以A为S,C为SO2,D为SO3,B为气体,应为H2S,
①E→C的化学方程式为Cu+2H2SO4(浓) $\frac{\underline{\;△\;}}{\;}$CuSO4+SO2↑+2H2O或C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓) $\frac{\underline{\;△\;}}{\;}$CuSO4+SO2↑+2H2O或C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
②A→C的反应为S(g)+O2(g)═SO2(g),每转移1mol e-就会放热143.5kJ,则转移4mol电子吸收143.5kJ×4=574.0kJ热量,则反应的热化学方程式为S(g)+O2(g)═SO2(g)△H=-574.0 kJ/mol,
故答案为:S(g)+O2(g)═SO2(g)△H=-574.0 kJ/mol;
(2)①A为单质,B、C均属于盐类,D是一种白色沉淀,若B的水溶液呈酸性,C的水溶液呈碱性,则由转化关系可知A为Al,B为AlCl3,C为NaAlO2,D为Al(OH)3,B溶液呈酸性的原因是铝离子水解使溶液呈酸性,离子方程式为Al3++3H2O?Al(OH)3+3H+,
故答案为:Al3++3H2O?Al(OH)3+3H+;
②若B溶液呈黄色,与苯酚溶液混合后显紫色,可说明B中含有Fe3+,A应为Fe,C中含有Fe2+,E是一种不溶性碱,由转化关系可知D为Fe(OH)2,E为Fe(OH)3,B→C的离子方程式为2Fe3++Fe═3Fe2+,D→E的化学方程式为4Fe(OH)2+O2+2H2O═4Fe(OH)3,若要实现Fe(OH)3到FeCl2的转化,应该加入还原性的酸氢碘酸(或HI),所以R为,用HI与Fe(OH)3反应,反应的离子方程式为2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O,
故答案为:2Fe3++Fe═3Fe2+;4Fe(OH)2+O2+2H2O═4Fe(OH)3;氢碘酸(或HI);2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O;
(3)若A~E均为化合物.A是淡黄色固体;B、C两溶液在等物质的量浓度时,C 溶液的pH较小.电解D的水溶液是最重要的工业生产之一,D→E→C也是工业制备C的普遍方法,则各物质分别是A 为Na2O2;B为NaOH;C为Na2CO3;D 为NaCl;E为NaHCO3.Y为Na,设Na的物质的量为x,K的物质的量为y,由质量守恒23x+39y=5.05;由得失电子守恒x+y=0.075×2,可知x=0.05,y=0.1,所以化学式为NaK2,
故答案为:NaK2.
点评 本题考查无机物的推断,注意利用信息及转化关系图推断各物质是解答的关键,习题综合性较强,涉及热化学反应、离子反应及溶液中物料守恒、电荷守恒的考查,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 编号 | 第Ⅰ栏 | 第Ⅱ栏 | 第Ⅲ栏 |
| A | H2SO4溶液中滴加Ba(OH)2至恰好沉淀完全 | 在NaHSO4溶液中滴加Ba(OH)2至中性 | H++SO42-+Ba2++OH-═BaSO4↓+H2O |
| B | 氢氧化钠溶液中通入过量CO2 | 氢氧化钙溶液中滴入过量CO2 | OH-+CO2═HCO3- |
| C | 向碳酸氢铵溶液中加过量澄清石灰水 | 向碳酸氢钠溶液中加过量澄清石灰水 | HCO3-+Ca2++OH-═CaCO3↓+H2O |
| D | FeBr2溶液和少量Cl2反应 | FeI2溶液和少量Cl2反应 | 2Fe2++Cl2═2Fe3++2Cl- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在1 L 2 mol•L-1的硝酸镁溶液中含有的硝酸根离子数为2NA | |
| B. | 2.3 g Na变成Na+时失去的电子数目为0.2NA | |
| C. | 1 mol H2O的质量与NA个H2O的质量之和相等 | |
| D. | 在通常状况下,22.4 L O2与N2的混合物所含分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 化学反应事实 | 影响化学反应因素 |
| A | 铁丝在空气中很难燃烧,而在氧气中能剧烈燃烧 | 反应物浓度 |
| B | 碳在常温下不与氧气发生反应,而在高温时能与氧气反应 | 反应温度 |
| C | 水在通电的条件才能分解,双氧水只要加入二氧化锰就迅速分解 | 催化剂 |
| D | 铜片在空气中很难燃烧,纳米铜粉在空气中较易燃烧 | 反应物的接触面积 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食用油属于有机物,石蜡属于无机物 | |
| B. | 食用油属于纯净物,石蜡属于混合物 | |
| C. | 食用油属于酯类物质,石蜡属于烃类 | |
| D. | 食用油属于高分子化合物,石蜡属于小分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaAlO2溶液通入过量的CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| B. | 磁性氧化铁(Fe3O4)溶于氢碘酸:Fe3O4+2I-+8H+═3Fe2++I2+4H2O | |
| C. | 用FeS除去工业废水中的Hg2+:Hg2++S2-═HgS↓ | |
| D. | 向饱和的Ca(OH)2溶液中滴加过量NaHCO3溶液:HCO3-+Ca2++OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑦ | B. | ②④⑥⑦ | C. | ②③④⑤ | D. | ①③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1molNa与O2在一定条件下生成Na2O和Na2O2混合物时,失去电子数为0.2NA | |
| B. | 50mL 12mol•L-1浓盐酸与足量二氧化锰加热反应,生成Cl2的分子数为0.15NA | |
| C. | 常温下,100mL 1mol•L-1Na2CO3溶液中阴离子总数等于0.1NA | |
| D. | 标准状况下,6.72LCO2中所含的共用电子对数为1.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com