
 =H2O(g) △H1=a kJ·
=H2O(g) △H1=a kJ·
 =2H2O(g) △H2=b kJ·
=2H2O(g) △H2=b kJ·
 =H2O(l) △H3=c kJ·
=H2O(l) △H3=c kJ·
 =2H2O(l) △H4=d kJ·
=2H2O(l) △H4=d kJ·
| A.a<c <0 | B.b>d>0 | C.2a=b<0 | D.2c=d>0 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
| A.①④ | B.②③ | C.①④⑤ | D.②④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
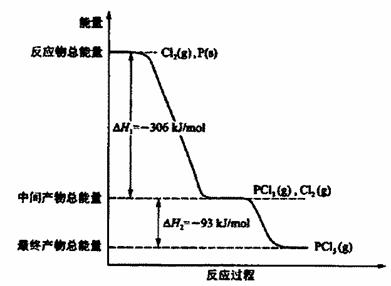
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.450kJ | B.650kJ | C.800kJ | D.520kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.C(s)+O2(g)===CO2(g)△H1 C(s)+1/2O2(g)===CO(g)△H2 |
| B.H2(g)+1/2O2(g)===H2O(l)△H1 2H2(g)+O2(g)===2H2O(l)△H2 |
| C.S(g)+O2(g)===SO2(g)△H1S(s)+O2(g)===SO2(g)△H2 |
| D.CaCO3(s)===CaO(s)+CO2(g) △H1 CaO(s)+H2O(l)===Ca(OH)2(s) △H2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
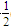 O2(g)===CO(g) ΔH2
O2(g)===CO(g) ΔH2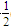 O2(g)===H2O(l) ΔH5
O2(g)===H2O(l) ΔH5| A.① | B.④ | C.②③④ | D.①②③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.已知:H2(g)+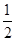 O2(g)===H2O(l);ΔH=-285.8 kJ·mol-1 ,则H2的燃烧热为-285.8 kJ·mol-1 O2(g)===H2O(l);ΔH=-285.8 kJ·mol-1 ,则H2的燃烧热为-285.8 kJ·mol-1 |
| B.已知:S(g)+O2(g)===SO2(g) ΔH1=-Q1 ;S(s)+O2(g)===SO2(g) ΔH2=-Q2,则Q1<Q2 |
C.已知: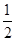 H2SO4(浓)+NaOH(aq)="==" H2SO4(浓)+NaOH(aq)="==" 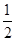 Na2SO4(aq)+H2O(l) ΔH1; Na2SO4(aq)+H2O(l) ΔH1;CH3COOH(aq)+NH3·H2O(aq)===CH3COONH4(aq)+H2O(l) ΔH2,则有|ΔH1|<|ΔH2| |
| D.已知:Fe2O3(s)+3C(石墨)===2Fe(s)+3CO(g)ΔH=+489.0 kJ·mol-1 |
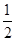 O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.当△H3+(△H1+△H2) >0时,该反应是吸热反应; |
| B.当 2△H3+(△H1+△H2) > 0时,该反应是放热反应; |
| C.当 2△H3+(△H1+△H2 ) <0时,该反应是放热反应; |
| D.当1/2△H3+(△H1+△H2)<0时,该反应是吸热反应; |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com