
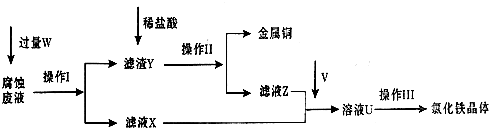
在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下,请回答下列问题:
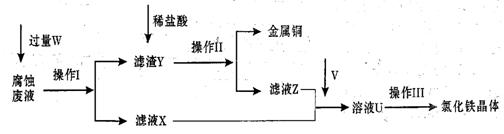
(1)请写出FeCl3溶液与铜反应的离子方程式: ;操作Ⅰ加入的试剂W是 。
(2)操作Ⅱ之前最好加入适量稀盐酸,某同学用10mol• L-1 的浓盐酸配制250mL 1mol• L-1 的稀盐酸,并进行有关实验。
①需要量取浓盐酸 mL。
②配制该稀盐酸时除量筒、烧杯、玻璃棒外,还必须用到的仪器有 、 。
③用已知浓度的氢氧化钠溶液滴定稀盐酸,滴定过程中眼睛应注视 ,实验时未用标准液润洗滴定管,测得锥形瓶中待测液的浓度 实际浓度。(填“>”、“<”或“=”)。
(3)操作Ⅲ前需要通入气体V,请写出实验室制取气体V的化学方程式: ,该反应中 是氧化剂。
(4)操作Ⅲ应在HCl气流氛围中进行,其原因是 。
(5)若通入的V的量不足,则最后制得的氯化铁晶体不纯净,这是因为溶液U中含有杂质 。请设计合理的实验,验证溶液U中的成分,并判断通入的V的量是否不足 (简要说明实验步骤、现象和结论)。
供选择的试剂:酸性KMnO4溶液、KSCN溶液、氯水。
(6)若向氯化铁溶液中加入一定量石灰水,调节溶液pH,可得红褐色沉淀。该过程中调节溶液的pH为5,则金属离子浓度为 。(己知:Ksp[Fe(OH)3]= 4.0×10-38)
(1)2Fe3+ + Cu == 2Fe2+ + Cu2+;(1分)铁粉或Fe(1分)
(2)
①25 mL。(2分)
②250mL容量瓶、胶头滴管。(每空1分)
③锥形瓶内溶液颜色的变化,大于。(每空1分)
(3)MnO2+4HCI(浓) = MnCI2+CI2↑+2H2O(1分),MnO2(1分)
(4)抑制Fe3+(或FeCI3)的水解(2分)
(5)FeCI2或Fe2+(1分)
取少量溶液U,加入几滴KSCN溶液,溶液显红色,则表明溶液U中有Fe3+(FeCI3);另取少量溶液U,加入几滴酸性KMnO4溶液,若KMnO4溶液退色,则表明溶液U中有Fe2+(或FeCI2),说明通入的V的量不足够若KMnO4溶液不退色,则说明通入的V的量 充足。(3分)
(6)4.0×10-11 mol·L-1(2分)


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
| 4.0×10-38 |
| (10-9)3 |
| 4.0×10-38 |
| (10-9)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省南通市海安县高一上学期期末考试化学试卷(带解析) 题型:实验题
(12分)在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
I:向废液中投入过量铁屑,充分反应后分离出固体和滤液:
II:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
试回答下列问题:
⑴FeCl3蚀刻铜箔反应生成FeCl2和CuCl2的离子方程式为 ;
证明蚀刻后的混合物溶液仍存在Fe3+的操作是:
。
⑵过程I加入铁屑的主要作用是_______ ;从固体中分离出铜需采用的方法是_________ 。
⑶过程II中发生主要反应的化学方程式为:_____ , 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题冲刺第9讲 金属及其化合物练习卷(解析版) 题型:填空题
在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
Ⅰ:向废液中投入过量铁屑,充分反应后分离出固体和滤液;
Ⅱ:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
已知:Ksp[Fe(OH)3]=4.0×10-38
回答下列问题:
(1)FeCl3蚀刻铜箔反应的离子方程式为________________________________________;
(2)过程Ⅰ加入铁屑的主要作用是__________________,分离得到固体的主要成分是________,从固体中分离出铜需采用的方法是___________________________________;
(3)过程Ⅱ中发生反应的化学方程式为________________________________;
(4)过程Ⅱ中调节溶液的pH为5,金属离子浓度为__________________________。(列式计算)
查看答案和解析>>
科目:高中化学 来源:2015届江苏省南通市海安县高一上学期期末考试化学试卷(解析版) 题型:实验题
(12分)在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
I:向废液中投入过量铁屑,充分反应后分离出固体和滤液:
II:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
试回答下列问题:
⑴FeCl3蚀刻铜箔反应生成FeCl2和CuCl2的离子方程式为 ;
证明蚀刻后的混合物溶液仍存在Fe3+的操作是:
。
⑵过程I加入铁屑的主要作用是_______ ;从固体中分离出铜需采用的方法是_________ 。
⑶过程II中发生主要反应的化学方程式为:_____ , 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com