
有关短周期元素A、B、C、D、E、F的信息如下:
元素 有关信息
A 最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐
B 最外层电子数是次外层电子数的2倍
C M层上有3个电子
D 短周期原子半径最大的主族元素
E 其单质是淡黄色固体
F 最高正价与最低负价代数和为6
请回答下列问题:
(1)写出实验室制取乙的化学方程式 。
(2)下列说法正确的是 (填序号)。
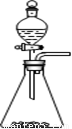
① 实验室可用如图所示装置制取B的最高价氧化物
② 用C单质做成的槽车,都可用来运输甲的浓溶液
③ C和铜与稀硫酸组成的原电池,C电极被还原
④ D单质在氧气中燃烧后的产物可用在防毒面具中作供氧剂
⑤ 鼓励乘坐公交车出行,倡导低碳生活,是控制和治理BO2解决“温室效应”的有效途径之一
 ⑥ DF的电子式为H∶Cl∶
⑥ DF的电子式为H∶Cl∶
(3)将E的常见氧化物(该氧化物能使品红溶液褪色)通入由CuSO4和NaCl混合的浓溶液中,溶液颜色变浅,析出白色沉淀,取该沉淀进行元素质量分数分析,可知其中含Cl:35.7%,Cu:64.3%,则该氧化物在上述反应中的作用是 。
A.漂白剂 B.氧化剂 C.还原剂
(4)请用化学方法加以验证(3)中的氧化物,简要写出实验方法、试剂及预期可观察到的现象 。
(1)Ca(OH)2+2NH4Cl CaCl 2+2NH3↑+ 2H2O
CaCl 2+2NH3↑+ 2H2O
(2)①②④⑤ (少选1个得1分,少选2个或多选不得分)(3)C
(4)将适量气体样品通入品红溶液,溶液红色褪去,加热溶液,又恢复红色,说明气体为SO2(其他合理答案也可)
【解析】
试题分析:A最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐,则A是氮元素,甲是硝酸,乙是氨气,生成的盐是硝酸铵。B最外层电子数是次外层电子数的2倍,则B一定是第二周期元素,是碳元素。C M层上有3个电子,所以C是Al元素。D短周期原子半径最大的主族元素,则D是Na元素。E其单质是淡黄色固体,所以E是S元素。F最高正价与最低负价代数和为6,这说明F是第 ⅦA族元素,则F是氯元素。
(1)实验室制取氨气的化学方程式为Ca(OH)2+2NH4Cl CaCl 2+2NH3↑+ 2H2O。
CaCl 2+2NH3↑+ 2H2O。
(2)实验室用碳酸钙与盐酸反应制取CO2,属于固体与液体反应不需要加热的,因此装置图正确,①正确;常温下铝在浓硝酸中发生钝化,所以可以用铝单质做成的槽车,都可用来运输甲的浓溶液,②正确;铝的金属性强于铜,所以铝和铜与稀硫酸组成的原电池,铝电极是负极被氧化,③不正确;过氧化钠能和水以及CO2反应生成氧气,所以钠单质在氧气中燃烧后的产物可用在防毒面具中作供氧剂,④正确;鼓励乘坐公交车出行,倡导低碳生活,是控制和治理CO2解决“温室效应”的有效途径之一,⑤正确;钠和氯是活泼的金属与非金属,二者形成的化合物氯化钠是离子化合物,电子式为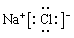 ,⑥不正确,答案选①②④⑤。
,⑥不正确,答案选①②④⑤。
(3)将E的常见氧化物(该氧化物能使品红溶液褪色),这说明该氧化物是SO2。SO2通入由CuSO4和NaCl混合的浓溶液中,溶液颜色变浅,析出白色沉淀,取该沉淀进行元素质量分数分析,可知其中含Cl:35.7%,Cu:64.3%,则该沉淀中Cl与Cu的原子个数之比=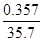 :
: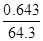 =1:1,所以其化学式为CuCl,即铜元素的化合价从+2价降低到+1价,这说明反应中硫酸铜起到氧化剂的作用,则SO2起到还原剂的作用,答案选C。
=1:1,所以其化学式为CuCl,即铜元素的化合价从+2价降低到+1价,这说明反应中硫酸铜起到氧化剂的作用,则SO2起到还原剂的作用,答案选C。
(4)SO2具有漂白性,能使品红溶液褪色,所以检验SO2的实验操作是将适量气体样品通入品红溶液,溶液红色褪去,加热溶液,又恢复红色,说明气体为SO2。
考点:考查元素周期表的结构以及核外电子排布;氨气、CO2制备;过氧化钠用途;原电池判断以及SO2的性质与检验等


科目:高中化学 来源: 题型:
 下表中列出五种短周期元素A、B、C、D、E的信息,请推断后作答:
下表中列出五种短周期元素A、B、C、D、E的信息,请推断后作答:| 元素 | 有关信息 |
| A | 元素主要化合价为-2,原子半径为0.074n m |
| B | 所在主族序数与所在周期序数之差为4 |
| C | 原子半径为0.102n m,其单质在A的单质中燃烧,发出明亮的蓝紫色火焰 |
| D | 最高价氧化物的水化物,能按1:1电离出电子数相等的阴、阳离子 |
| E | 原子半径为0.075n m,最高价氧化物的水化物与其氢化物组成一种盐X |




 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | A | B | C | D |
| 有关性质或结构信息 | 能形成+7价的化合物 | 基态原子核外s能级上的电子数是p能级上的电子数的2倍 | 该元素形成的单质通常有两种同素异形体,其中一种单质分布在高空,起着阻止紫外辐射的作用 | 通常情况下能形成短周期中最稳定的双原分子分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 有关信息 |
| A | 所在主族序数与所在周期序数之差为4 |
| B | 原子半径为0.102nm,其两种常见氧化物的相对分子质量比为4:5 |
| C | 元素主要化合价为-2,原子半径为0.074nm |
| D | 最高价氧化物对应水化物溶于水能按1:1电离出电子数相等的阴、阳离子 |
| E | 原子半径为0.075nm,最高价氧化物对应的水化物与其氢化物反应生成盐X |
| F | 原子的最外层电子数等于2n-3(n为电子层数),化学反应中易失去最外层电子形成Fn+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com