
����Ŀ��Ϊ��ȷ���Ҵ����ӵĽṹ��ʽ��CH3��O��CH3����CH3CH2OH��ʵ����������ͼ��ʾ��ʵ��װ�ã��ⶨ�Ҵ����Ʒ�Ӧ(��H<0)������������������ݴ˼����Ҵ���������������Ʒ�Ӧ����ԭ�ӵ���Ŀ���Իش��������⣺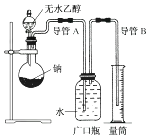
��1��ָ��ʵ��װ���еĴ�����
��2����ʵ�����ú�������ˮ���Ҵ�������ͬ��������ˮ�Ҵ�����ͬ�����£���õ����������(�ƫ��ƫС�����䡱)��
��3����ָ����ʹ��ʵ�鰲ȫ��˳�����еĹؼ�ʵ�鲽��(����ָ�������ؼ�����)
��
���𰸡�
��1�����ƿ�н�������Ӧ�ո��������,��ˮ����Ӧ�������ƿ�ײ�
��2��ƫ��
��3�����װ�õ�������,�����Թ����Ľ����ƣ������μ���ˮ�Ҵ�(�δ�2��,��������)
��������С��1����Ҫͨ�������ų�ˮ�����ȷ������H2����������ƿ�еĽ������ܲ�������̫��������ˮ����Ӧ���뵽���ƿ�ײ���
С��2�����ڵ�������ˮ���Ҵ���ˮ�����ʵ��������Ҵ��ģ������������ʱ������H2�����ʵ������ú�ˮ�Ҵ�������ˮ�Ҵ�ʱ������H2���ƫ��С��3��Ҫʹ��ʵ�鰲ȫ��˳�����У�����Ҫ��֤��װ�ò���©����Ϊʹ�ų�ˮ��������ڲ��������������������Ҵ����ٶȲ���̫�죬Ϊȷ�������Ҵ���ȫ��Ӧ��������Ӧ�Թ�����
С��1��ϴ��ƿ�е���Ӧ�����̳�����������������ˮ�ų��������Ա���̽�����
С��2��ˮ���Ҵ��������������ʵ�����ϵ����2:1������������ˮ���Ҵ���ˮ���ʵ���ҪԶԶ�����Ҵ������ú�ˮ�Ҵ�������ˮ�Ҵ�ʱ������H2���ƫ��
С��3�������Ʊ�ʵ������Ŀ��Ƿ��룺�����ԡ����ӡ���Ӧ�Ŀ��������Ϲ���ᵼ����������Ӧ���������ռ�������Ӧ�Ƿ���ȫ�����ء�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2015��˹̹����ѧ�о���Ա���Ƴ�һ�ֿ���һ��������ɳ�ŵ�ij������������ӵ�أ��ڲ���AlCl4�����л������ӹ��ɵ������Һ����ŵ繤��ԭ����ͼ��ʾ������˵������ȷ���ǣ� �� 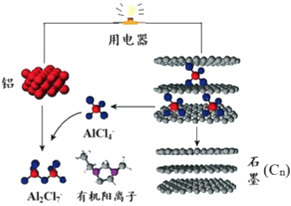
A.�ŵ�ʱ����Ϊ������ʯīΪ����
B.�ŵ�ʱ���л������������缫�����ƶ�
C.�ŵ�ʱ�ĸ�����ӦΪ��Al��3e��+7AlCl4���T4Al2Cl7��
D.���ʱ��������ӦΪ��Cn+AlCl4����e���TCnAlCl4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����к����ۡ�NaCl��Na2SO4��CaCl2�Ļ����Һ��ѡ���ʵ����Լ��ͷ��������ᴿ��NaCl���壮��Ӧ��ʵ�������ͼ��
��1�������������ý��岻��ͨ�����ѵ��۽������Һ���з��룮
��2��д������ʵ������������Լ��Ļ�ѧʽ���Լ������Լ��� ��
��3���ж��Լ����ѹ����IJ����ǣ� ��
��4�������Լ��������ķ����ǣ� ��
��5���Լ��ڵ����ã��û�ѧ����ʽ��ʾ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ж������������ȷ���ǣ� ��
A.��Ũ�������ǿ�����ԣ��ʲ�����������������
B.Ũ������Ũ��ˮ����ʱ������������
C.Ũ������ǿ�����ԣ�ϡ�������������
D.Ũ������и�ʴ�ԣ�ȡ��ʱҪС��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������廯����A����Ҫ���л�����ԭ�ϣ���A�Ʊ��л�������F�ĺϳ�·�ߣ����ַ�Ӧ������ȥ����ͼ��ʾ�� 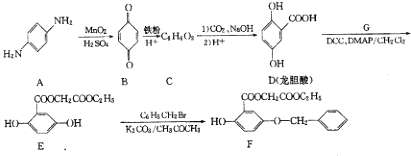
��1��A��ˮ��Һ��������ԡ��������ԡ�����
��2��C�Ľṹ��ʽΪ��
��3��д��E��F��Ӧ�Ļ�ѧ����ʽ��
��4��д���������������������������� 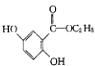 ����һ��ͬ���칹��Ľṹ��ʽ�� ���ܷ���������Ӧ �ڲ���FeCl3��Һ������ɫ��Ӧ����ˮ�����֮һ����FeCl3��Һ������ɫ��Ӧ
����һ��ͬ���칹��Ľṹ��ʽ�� ���ܷ���������Ӧ �ڲ���FeCl3��Һ������ɫ��Ӧ����ˮ�����֮һ����FeCl3��Һ������ɫ��Ӧ
�ۺ˴Ź�������������壬�ҷ����֮��Ϊ6��2��1��1
��5�����������ϳ�·�ߣ����һ�����ȱ����Ҵ�Ϊԭ���Ʊ�ˮ���������� 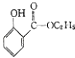 ���ĺϳ�·������ͼ�����Լ����ã��������Ϣ��
���ĺϳ�·������ͼ�����Լ����ã��������Ϣ��  ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ѧ��FuNvio Cacace���˻���˼��������о������N4���ӣ�N4���ӽṹ��ͼ��ʾ����֪����1molN��N����167kJ����������1mol N��N�ų�945kJ����������������Ϣ�����ݣ�����˵������ȷ���ǣ� �� 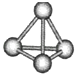
A.N4���������ɷǼ��Լ����ɵķ��Ӿ���
B.��Ԫ�طǽ����Ա���ǿ����֪N4�е��P4�����ף���
C.1mol N4����ת��ΪN2����ų�888kJ����
D.N4��N2��Ϊͬ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ʽ��з����ǻ�ѧѧϰ�еij��÷�����������������������ǣ� ��
A.CO
B.NaOH
C.HNO3
D.CuSO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������һ�����ʵ���Ũ�ȵ�Ũ��������480mL 3.68mol/L��ϡ���
��1��������18.4mol/L��Ũ����������Һ����Ҫ�õ�Ũ��������Ϊ ��
��2�����ƹ�������Ҫ���������е�������ţ���A��������ƽB���ձ�C.100������ͲD.50������ͲE����ƿF��������G����ͷ�ι�H���Թ�I����������ƿ
��3���뽫���и�����������ȷ��������ں����ϣ�
A.����Ͳ��ȡŨH2SO4
B.��Һ��ȴ������
C.�����ߵ�ҡ��
D.�ý�ͷ�ιܼ�����ˮ���̶���
E.ϴ����Ͳ
F.ϡ��ŨH2SO4
G.����Һת������ƿ
�������ȷ��˳������Ϊ�� �� ��
��4���ý�ͷ�ι�������ƿ�м�ˮʱ����С��Һ�泬���˿̶ȣ������ķ�����
������ţ���
A.��������Һ�壬ʹ��Һ����̶�������
B.���������һ������Ũ����
C.С�ļ�������ƿ����������ʹ��Һ����̶�������
D.��������
��5����������������Ƶ�ϡ����Ũ���к�Ӱ�죿����ƫ��ƫС����Ӱ����д��
A�����õ�Ũ���᳤ʱ��������ܷⲻ�õ�������
B������ƿ������ϴ�Ӻ������������ˮ
C������ʱ����
��6��������Ͳ��ȡŨ���ᣬ��������С�ĵؼ�������ˮ��������ȣ�����ȴ�����º��ټ���ˮ���̶��ߣ��ٽ�����ȣ�����Ϊ�˷��Ƿ���ȷ��������ȷ��ָ�����д���֮�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڽ������ʶ�д������ �� ��
A. �ᴿ���岻�ܲ��ù��˵ķ���
B. ���ö����ЧӦ����������Һ�ͽ���
C. �������Һ�ȶ�
D. ��Һ�ǵ����Եģ������Ǵ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com