
常温下,对下列电解质溶液的有关说法一定正确的是( )
A.相同浓度和体积的强碱和强酸溶液混合后,溶液的pH=7
B.在NaHCO3溶液中,c(CO32—)>c(HCO3—)
C.在有AgCl沉淀的溶液中加入NaCl固体,c(Ag+)减小
D.将pH相等的CH3COONa和Na2CO3溶液稀释相同倍数,CH3COONa溶液的pH较大
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014高考化学名师知识点精编 专题13铁、铜及其重要化合物练习卷(解析版) 题型:选择题
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示。则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3的物质的量浓度之比为( )
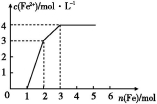
A.1∶1∶1 B.1∶3∶1 C.3∶3∶8 D.1∶1∶4
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题9电化学原理练习卷B(解析版) 题型:填空题
用惰性电极电解NaCl与NaHCO3的混合溶液,测得溶液的pH变化如图所示。
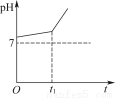
(1)在0→t1时间内,两个电极上的电极反应式为:
阳极:________________________________________________________________________;
阴极:________________________________________________________________________。
(2)用离子方程式表示0→t1时间内,溶液pH升高比较缓慢的原因:____________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题9电化学原理练习卷A(解析版) 题型:选择题
根据图所示装置,下列说法不正确的是( )
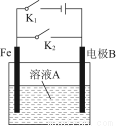
选项开关状态溶液A电极B说明
A打开K1,闭合K2NaCl石墨正极反应:O2+2H2O+4e-=4OH-
B打开K1,闭合K2NaClZn铁制品保护:牺牲阳极的阴极保护法
C打开K2,闭合K1CuSO4Cu铁表面镀铜
D打开K2,闭合K1CuSO4粗铜电解法精炼铜
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题8电解质溶液练习卷B(解析版) 题型:选择题
化学平衡常数(K)、弱酸的电离平衡常数(Ka)、难溶物的溶度积常数(Ksp)是判断物质性质或变化的重要的平衡常数。下列关于这些常数的说法中,正确的是( )
A.平衡常数的大小与温度、浓度、压强、催化剂等有关
B.当温度升高时,弱酸的电离平衡常数Ka变小
C.Ksp(AgCl)>Ksp(AgI),由此可以判断AgCl(s)+I-(aq)=AgI(s)+Cl-(aq)能够发生
D.Ka(HCN)<Ka(CH3COOH),说明物质的量浓度相同时,氢氰酸的酸性比醋酸强
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题8电解质溶液练习卷A(解析版) 题型:填空题
工业上将制取重铬酸钾(K2Cr2O7)和铬酸酐(CrO3)的剩余废渣称为铬渣,其成分为SiO2、Al2O3、MgO、Fe2O3、CrO3、K2Cr2O7等。
已知:
①重铬酸钾和铬酸酐都易溶于水,这是造成铬污染的主要原因,它们都是强氧化剂,铬酸酐溶于水呈酸性;
②+6价铬易被人体吸收,可致癌;+3价铬不易被人体吸收,毒性小。
③下表为一些金属氢氧化物沉淀的pH参照数据。
物质 | 开始沉淀 | 完全沉淀 |
Fe(OH)3 | 2.7 | 3.7 |
Al(OH)3 | 3.7 | 4.7 |
Cr(OH)3 | 4.7 | a |
Fe(OH)2 | 7.6 | 9.6 |
Mg(OH)2 | 9.6 | 11.1 |
回答下列处理铬渣、消除铬污染的有关问题:
(1)将铬渣用稀硫酸浸取、过滤,在浸出液中加入适量的绿矾(FeSO4·7H2O),加入绿矾的目的是_____________________________________________
(2)再向浸出液中缓慢加入烧碱,至pH刚好达到4.7,过滤,所得沉淀的化学式是____________________________________________________________;
常温下,Cr(OH)3的溶度积Ksp=10-32,要使Cr3+完全沉淀[c(Cr3+)降至10-5 mol·L-1视为沉淀完全],溶液的pH应调于a=________。
(3)向(2)中得到的滤液中加入硫酸,调节至呈强酸性,所得的溶液是含____________________溶质的溶液。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题7化学反应速率和化学平衡练习卷A(解析版) 题型:选择题
某研究性活动小组在实验室用三份不同初始浓度的氨基甲酸铵(NH2COONH4)溶液在不同温度下进行水解实验:NH2COONH4+2H2O NH4HCO3+NH3·H2O,经测得c(NH2COO-)与反应时间的关系如图所示。据图判断下列说法正确的是( )
NH4HCO3+NH3·H2O,经测得c(NH2COO-)与反应时间的关系如图所示。据图判断下列说法正确的是( )
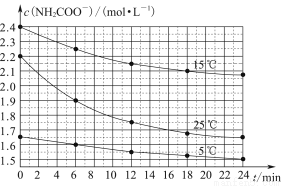
A.0~12 min,初始浓度越大的实验,水解反应速率越大
B.c(NH2COO-)将随反应时间的不断延长而一直减小至0
C.25 ℃时0~6 min,v(NH2COO-)为0. 05 mol·L-1·min-1
D.15 ℃时,第30 min时,c(NH2COO-)为2.0 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题4离子反应练习卷(解析版) 题型:选择题
下列离子方程式书写正确的是( )
A.氯化钙溶液中通入CO2气体:Ca2++CO2+H2O=CaCO3↓+2H+
B.碳酸钠溶液中逐滴加入等物质的量的盐酸:CO32—+2H+=CO2↑+H2O
C.Ca(ClO)2溶液中通入过量的SO2气体:ClO-+SO2+H2O=HClO+HSO3—
D.碳酸氢钙溶液中加入等物质的量的氢氧化钠溶液:Ca2++HCO3—+OH-=CaCO3↓+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com