
【题目】下列事实可证明NH3·H2O是弱碱的是( )
A.氨水能与氯化镁反应生成氢氧化镁
B.氨水能与硫酸发生中和反应
C.0.2 mol·L-1氨水与0.2 mol·L-1盐酸等体积混合后,溶液pH约为5
D.氨水可以使酚酞溶液变红
【答案】C
【解析】
部分电离的电解质是弱电解质,要证明一水合氨是弱电解质,只要确定一水合氨部分电离即可,据此分析解答。
A.氨水和氯化镁溶液反应生成氢氧化镁,说明氨水溶液呈碱性,不能说明一水合氨部分电离,所以不能证明氨水是弱碱,故A错误;
B.氨水能与硫酸发生中和反应,只能证明一水合氨属于碱,不能判断其碱性强弱,故B错误;
C.0.2 mol·L-1氨水与0.2 mol·L-1盐酸等体积混合后,碱与酸恰好完全中和,溶液中的溶质只有![]() ,该溶液显酸性,说明
,该溶液显酸性,说明![]() 属于强酸弱碱盐,溶液显酸性,从而证明一水合氨是弱碱,故C正确;
属于强酸弱碱盐,溶液显酸性,从而证明一水合氨是弱碱,故C正确;
D.氨水可以使酚酞溶液变红,说明溶液显碱性,但不能确定碱性的强弱,因此,不能证明NH3·H2O是弱碱,故D错误;
答案选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】二氧化钒(VO2)是一种新型热敏材料。实验室以V2O5为原料合成用于制备VO2的氧钒( IV )碱式碳酸铵晶体,过程如下:
V2O5![]() VOCl2溶液
VOCl2溶液![]() (NH4)5[(VO)6(CO3)4(OH)9]10·H2O
(NH4)5[(VO)6(CO3)4(OH)9]10·H2O
回答下列问题:
(1)步骤i中生成VOCl2的同时生成一种无色无污染的气体,该反应的化学方程式为____。也可只用浓盐酸与V2O5来制备VOCl2溶液,从环境角度考虑,该方法的缺点是_______。
(2)步骤ii可在如图装置(气密性良好)中进行。已知:VO2+能被O2氧化。

①药品填装完成后的实验操作是____(填活塞“a”“b”的操作)。
②若无装置B,则导致的后果是____。
(3)加完VOCl2后继续搅拌数分钟,使反应完全,小心取下分液漏斗,停止通气,立即塞上橡胶塞,将锥形瓶置于CO2保护下的干燥器中,静置过夜,得到紫红色晶体,抽滤,并用饱和NH4HCO3溶液洗涤3次,用无水乙醇洗涤2次,除去水分,再用乙醚洗涤2次,抽干称重。用饱和NH4 HCO3溶液洗涤除去的阴离子主要是____。
(4)测定氧钒( IV )碱式碳酸铵晶体粗产品中钒的含量。
称量4.246g样品于锥形瓶中,用20mL蒸馏水与30mL硫酸混合溶解后,加0.02 mol·L-1的KMnO4溶液至稍过量,充分反应后继续加1% NaNO2溶液至稍过量,再用尿素除去过量的NaNO2 ,最后用0.08 mol·L-1的(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗体积为30.00 mL。(滴定反应:VO2+ + Fe2++2H+=VO2++ Fe3++H2O)
①NaNO2溶液的作用是____。
②粗产品中钒的质量分数为____(精确到小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以炼锌烟尘(主要成分为ZnO,含少量CuO和FeO)为原料,制取氯化锌晶体(ZnCl2·xH2O)的工艺流程如图:
已知:Zn及其化合物的性质与Al及其化合物的性质相似,pH>11时,Zn(OH)2能溶于NaOH溶液生成ZnO22-。
(1)碱溶时加入过量NaOH溶液的目的是___,发生反应的化学方程式是___。
(2)沉淀A的主要成分的化学式是___。
(3) “调pH”步骤中通入过量CO2,化学反应方程式___。
(4)酸溶时发生反应的离子方程式是___。
(5)一系列操作过程中的一系列操作是:___、___、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化碱法是工业上制备Na2S2O3的方法之一,反应原理:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2(该反应ΔH>0),某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O流程如下:
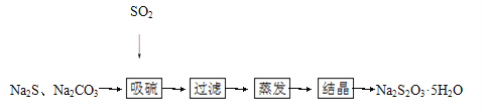
(1)吸硫装置如图所示:
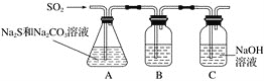
①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是____________,表明SO2吸收效率低的实验现象是B中_________。
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是________、________。(写出两条)
(2)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:准确称取ag KIO3(化学式量:214)固体配成溶液,加入过量KI固体和H2SO4溶液,滴加指示剂,用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为VmL。则c(Na2S2O3)=_________ mol·L-1。(只列出算式,不作运算)已知:![]() +I2=
+I2=![]() +2I-
+2I-
(3)某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的Na2S2O3浓度可能 ____(填“无影响”、“偏低”或“偏高”),原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蛋白质是构成生物体的基本物质,蛋白质的组成元素主要有氢、碳、氮、氧、硫,同时还有微量元素铁、锌等。回答下列问题:
(1)在基态![]() 原子中,核外电子占据的最高能级的电子云轮廓图为________形。
原子中,核外电子占据的最高能级的电子云轮廓图为________形。
(2)常见的含氮微粒有![]() 、
、![]() 、
、![]() 等。与
等。与![]() 互为等电子体的分子为________(写出一种)。根据价层电子对互斥理论,可推知
互为等电子体的分子为________(写出一种)。根据价层电子对互斥理论,可推知![]() 的空间构型为________,
的空间构型为________,![]() 比
比![]() 更容易液化的原因是________。
更容易液化的原因是________。
(3)将足量的氨水逐滴加入到![]() 溶液中,先生成沉淀,然后沉淀溶解生成配合物
溶液中,先生成沉淀,然后沉淀溶解生成配合物![]() ,该配合物中的阳离子结构式为________;
,该配合物中的阳离子结构式为________;![]() 中的硫原子杂化方式为________;用价层电子对互斥理论解释
中的硫原子杂化方式为________;用价层电子对互斥理论解释![]() 的键角大于
的键角大于![]() :________。
:________。
(4)碲化锌晶体有两种结构,其中一种晶胞结构如图:晶胞中与Zn原子距离最近的Te原子围成________形;与Te原子距离最近的Te原子有________个;若与Zn原子距离最近的Te原子间距为apm,则晶体密度为________![]() (列出计算式即可)。
(列出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.12 g 金刚石中含有的共用电子对数为NA
B.1 mol AlCl3在熔融时离子总数为0.4NA
C.0.2 mol MnO2与足量浓盐酸反应转移的电子数小于 0.4NA
D.1 L 0.1 mol·Lˉ1 Na2CO3溶液中含有阴离子数大于 0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家设计二氧化碳熔盐捕获及电化学转化装置,其示意图如下:

下列说法不正确的是
A. b为电源的正极
B. ①②中,捕获CO2时碳元素的化合价发生了变化
C. a极的电极反应式为2C2O52 4e == 4CO2 + O2
D. 上述装置存在反应:CO2 ===== C + O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M(如图所示)可用于制备各种高性能防腐蚀涂料。W、X、Y、Z是原子序数依次增大的短周期主族元素,且占据三个不同周期,W与Z的质子数之和是X的2倍。下列说法不正确的是
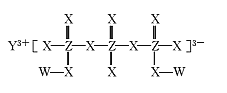
A.原子半径:Y>Z>X
B.X元素的族序数是Y元素的2倍
C.工业上电解熔融Y2X3化合物制备单质Y
D.W与X形成的所有化合物都只含极性共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com