
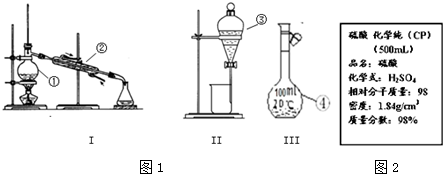
分析 (1)根据常见仪器的名称来回答;
(2)分液漏斗和100mL容量瓶在使用前要检查是否漏水;
(3)a.根据溶液的物质的量浓度C=$\frac{1000ρω}{M}$来计算;
b.根据操作步骤有计算、量取、稀释、洗涤、定容、摇匀等操作来确定仪器;
c.根据溶液稀释定律C浓V浓=C稀V稀来计算;
d.分析操作对溶质物质的量、溶液体积的影响,根据c=$\frac{n}{V}$判断对所配溶液浓度的影响.
解答 解:(1)因①②③仪器的名称分别为:蒸馏烧瓶、冷凝管、分液漏斗;
故答案为:蒸馏烧瓶;冷凝管;分液漏斗;
(2)因分液漏斗和100mL容量瓶在使用前要检查是否漏水,蒸馏烧瓶、冷凝管不需要检查是否漏水;
故答案为:③④;
(3)a.溶液的物质的量浓度C=$\frac{1000ρω}{M}$=$\frac{1000×1.84g/ml×98%}{98g/mol}$=18.4mol/L;
故答案为:18.4;
b.操作步骤有计算、量取、稀释、洗涤、定容、摇匀等操作,一般用量筒量取浓硫酸,在烧杯中稀释(可用量筒量取水加入烧杯),并用玻璃棒搅拌,冷却后转移到500mL容量瓶(由于无480ml容量瓶,故选用500ml容量瓶)中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以所需仪器有量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管,
故答案为:500mL容量瓶;
c.由于无480ml容量瓶,故选用500ml容量瓶,配制480mL 1mol•L-1的稀硫酸,设需要的浓硫酸的体积为Vml,根据溶液稀释定律C浓V浓=C稀V稀可知:18.4mol/L×Vml=1mol•L-1×500mL,解得V=27.2mL;
故答案为:27.2;
d.A.定容时,俯视容量瓶刻度线进行定容,故导致稀溶液体积偏小,根据c=$\frac{n}{V}$判断可知浓度偏高,故A正确;
B.将稀释后的稀硫酸立即转入容量瓶后,紧接着就进行以后的实验操作,一旦冷却下来,导致稀溶液体积偏小,根据c=$\frac{n}{V}$判断可知浓度偏高,故B正确;
C.转移溶液时,不慎有少量溶液洒到容量瓶外面,导致浓溶液物质的量偏小,根据c=$\frac{n}{V}$判断可知浓度偏低,故C错误;
D.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水,配制过程中需要滴加蒸馏水,故此无影响,故D错误;
E.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处,导致稀溶液体积偏大,根据c=$\frac{n}{V}$判断可知浓度偏低,故E错误;
故选AB.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,注意c=$\frac{n}{V}$理解应用,题目难度不大.


科目:高中化学 来源:2016-2017学年陕西省高一上第一次月考化学卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,22.4LCl2和HCl的混合气体所含分子总数为2NA
B.常温常压下,18 g H2O中含有的原子总数为3 NA
C.标准状况下,11.2 L CH3CH2OH中含有的分子数目为0.5 NA
D.1 L 0.1 mol/L NaOH溶液含有阴阳离子总数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中导电粒子的数目减少 | |
| B. | 再加CH3COONa固体促进醋酸的电离 | |
| C. | 醋酸的电离程度增大,c(H+)亦增大 | |
| D. | 溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
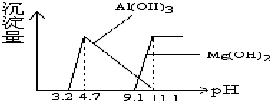 根据Al(OH)3 的Ksp=1.3×10-33、Mg(OH) 2的Ksp=5.6×10-12,等物质的量浓度AlCl3、MgCl2混合溶液与NaOH溶液反应生成相应沉淀,pH与沉淀量关系如下图:
根据Al(OH)3 的Ksp=1.3×10-33、Mg(OH) 2的Ksp=5.6×10-12,等物质的量浓度AlCl3、MgCl2混合溶液与NaOH溶液反应生成相应沉淀,pH与沉淀量关系如下图:| A. | Al(OH)3 和Mg(OH)2在水溶液中的电离过程完全相同 | |
| B. | 若改变溶液的pH,在pH<4.7时,n(Mg2+)几乎不变化 | |
| C. | 当pH>11.1时,溶液中只有NaCl和NaAlO2(Na[Al(OH)4]) | |
| D. | 等物质的量浓度Al3+、Mg2+混合溶液与氨水反应生成相应沉淀,氨水的pH与沉淀量关系与上图相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的pH | B. | 醋酸的电离常数 | ||
| C. | 中和时所需NaOH的量 | D. | 溶液中的c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4═H22++SO42- | B. | NaHCO3═Na++H++CO32- | ||
| C. | Ba(OH)2═Ba2++2(OH)- | D. | Na3PO4═3Na++PO43- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积 (mL) | 标准KMnO4溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 3.00 | 23.00 |
| 第三次 | 25.00 | 4.00 | 24.10 |
| 难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加过程中,当溶液中c(Cu 2+)=2.2×10-2mol/L时,溶液的pH=9 | |
| B. | 滴加过程中,当溶液的pH=7时,溶液中2c(NH4+)=c(SO4 2-) | |
| C. | 若滴加pH=11的Na0H溶液,Cu2+完全沉淀时消耗溶液的体积小于V | |
| D. | 若将氨水加水稀释,则稀释过程中,c(NH4+)/c(NH3•H2O)始终保持增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
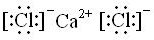 ,属于离子化合物.
,属于离子化合物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com