
| A. | 使用合适催化剂可以加快反应速率 | |
| B. | 升高温度可以增大反应速率 | |
| C. | 达到化学平衡时,N2、H2和NH3物质的量浓度一定相等 | |
| D. | 若反应在密闭容器中进行,N2和H2不可能100%转化为NH3 |
科目:高中化学 来源: 题型:选择题
| A. | C70与金刚石一样属于原子晶体 | |
| B. | 共价化合物中一定不含离子键 | |
| C. | I2升华破坏了共价键 | |
| D. | HCl溶于水能电离子出H+、Cl-,所以HCl是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

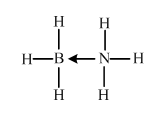 (必须标明配位犍).
(必须标明配位犍).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为测定熔融氢氧化钠的导电性,可将氫氧化钠固体放在石英坩埚中加热熔化 | |
| B. | 采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,可提高空气质量 | |
| C. | 铝及其合金是电气、工业、家庭广泛使用的材料,是因为铝的冶炼方法比较简单 | |
| D. | 半导体行业中有一句话:“从沙滩到用户”,计箅机芯片的材料是经提纯的二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
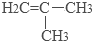 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 定容时仰视刻度线 | |
| B. | 定容后摇匀、静置,发现液面低于刻度线,又加水至刻度线 | |
| C. | 烧杯中的溶液未冷却至室温就将溶液移到容量瓶中 | |
| D. | 容量瓶洗涤后仍有少量残留 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com