
 如图是一种试验某气体化学性质的实验装置,图中B为开关. 如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去.则D瓶中盛有的溶液是( )
如图是一种试验某气体化学性质的实验装置,图中B为开关. 如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去.则D瓶中盛有的溶液是( )| A、浓H2SO4 |
| B、饱和NaCl溶液 |
| C、浓NaOH溶液 |
| D、饱和Na2CO3 |


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
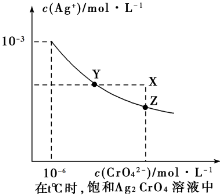
| A、在t℃时,Ag2CrO4的Ksp为1×10-9 |
| B、在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点 |
| C、在t℃时,以0.01 mol/LAgNO3溶液滴定20 mL 0.01 mol/LKCI和0.01 mol/L的K2CrO4的混和溶液,CrO42-先沉淀 |
| D、在t℃时,反应Ag2CrO4(s)+2 Cl-(aq)?2AgCl(s)+CrO42-(aq)的平衡常数K=2.5×107 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验需用到的主要玻璃仪器包括大、小烧杯,温度计,环形玻璃搅拌棒及泡沫塑料板、碎泡沫塑料(或硬纸板、碎纸条)等 |
| B、盐酸与某强碱中和放出的热量随反应物用量的改变而改变,但中和热不变 |
| C、NaOH稍过量的目的是保证盐酸完全被NaOH中和 |
| D、测定结果准确与否的关键是尽量减小热量损失及准确读取混合溶液的最高温度等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NO2 |
| B、NO |
| C、N2O |
| D、N2O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
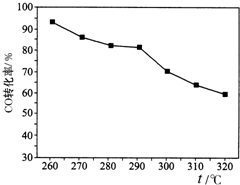 二甲醚(CH3OCH3)是一种新型能源.由合成气(组成为H2、CO和少量的CO2)合成二甲醚的三步反应如下:
二甲醚(CH3OCH3)是一种新型能源.由合成气(组成为H2、CO和少量的CO2)合成二甲醚的三步反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠应保存在水里以隔绝空气 |
| B、常温下铁能与水蒸气反应生成氢氧化铁和氢气 |
| C、可以用铁制品或铝制品容器盛冷的浓H2SO4 |
| D、铝较活泼,所以铝制品在空气中不能稳定存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com