
| A. | 当X是盐酸时,则F是稀硝酸24 | |
| B. | 当X是氢氧化钠时,则F是稀硝酸y | |
| C. | 当X是氢氧化钠时,B跟Cl2反应可能有白烟现象e | |
| D. | 当X是氢氧化钠时,B能使酸性高锰酸钾溶液褪色N |
分析 当X是盐酸时,A是金属或金属氧化物,B是盐,盐和氯气反应不可能生成氮气或氨气;当X是氢氧化钠时,铵盐能和氢氧化钠反应生成氨气,氨气和氯气反应生成氮气,氮气和氧气反应生成一氧化氮,一氧化氮和氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸.
解答 解:A.当X是盐酸时,A是金属或金属氧化物,金属或金属氧化物和酸反应生成盐B,如果盐B能和氯气反应生成C,则C也是盐,且是高价盐,C和氧气不反应,所以不能最后生成硝酸,故A错误;
B.当X是氢氧化钠时,A是铵盐,铵盐和氢氧化钠反应生成氨气B,氨气和氯气反应生成氮气和氯化铵,氮气和氧气反应生成一氧化氮,一氧化氮和氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸,则F是硝酸,符合条件,故B正确;
C.当X是氢氧化钠时,A是铵盐,铵盐和氢氧化钠反应生成氨气B,氨气和氯气反应生成氮气和固体氯化铵,所以有白烟生成,故C正确;
D.当X是氢氧化钠时,A是硫化氢,硫化氢和氢氧化钠反应生成硫化钠,硫化钠和氯气反应生成氯化钠和硫,硫在氧气中燃烧生成二氧化硫,二氧化硫和氧气在一定条件下反应生成三氧化硫,三氧化硫和水反应生成硫酸,硫化氢有还原性,酸性高锰酸钾溶液有强氧化性,所以硫化氢能使高锰酸钾溶液褪色,故D正确;
故选A.
点评 本题考查了物质推断,明确物质性质及物质间的反应是解本题关键,难度较大,注意基础知识的积累和运用.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,46g NO2和N2O4含有2NA个氧原子 | |
| B. | 1mol Na中约含NA个电子 | |
| C. | 4gNaOH中含有NA个OH- | |
| D. | 标况下,22.4LHF中含有NA个HF分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
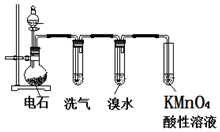 如图为实验室制取乙炔并验证其性质的装置图,回答下列问题:
如图为实验室制取乙炔并验证其性质的装置图,回答下列问题: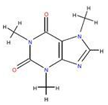 ,实验室可通过下列简单方法从茶叶中提取咖啡因:
,实验室可通过下列简单方法从茶叶中提取咖啡因: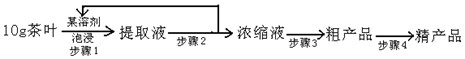
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
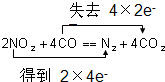
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮原子的质量就是氮的相对原子质量 | |
| B. | 氢氧化钠的摩尔质量是40 g | |
| C. | 1mol H2SO4中含有1mol H2 | |
| D. | 氩气的摩尔质量在数值上等于它的相对原子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 以NaCl等为原料制备KClO4的过程如下:
以NaCl等为原料制备KClO4的过程如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com