
| 化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-34 | 10-16 | 10-38 |
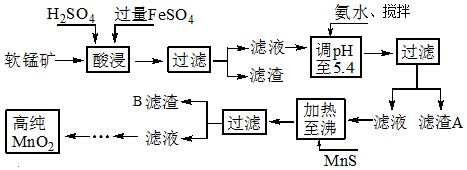
分析 软锰矿的主要成分为MnO2,还含有Si、Fe、Al、Zn和Cu等元素的化合物,硫酸亚铁在酸性条件下将MnO2还原为MnSO4,所以酸浸后的滤液中的金属阳离子主要是Mn2+、Fe3+、Al3+、Cu2+、Zn2+、Fe2+等,由离子开始沉淀及沉淀完全的pH可知,调节pH为5.4,将Fe3+、Al3+沉淀,加入硫化锰将Cu2+、Zn2+沉淀,滤液为硫酸锰溶液,再通过系列变化得到高纯度的二氧化锰,
(1)根据FeSO4在反应条件下将MnO2还原为MnSO4,则Fe2+被氧化为Fe3+,故酸浸时生成硫酸锰、硫酸铁,根据元素守恒还有水生成;
(2)加入氨水搅拌加快反应速率,生成的氢氧化亚铁充分氧化,加入氨水需调节pH至少达到5.4沉淀铁离子和铝离子;
(3)根据工艺流程及硫化物的Ksp判断;
(4)根据反应式Zn+2MnO2+2H2O═Zn(OH)2+2MnOOH可知,在反应中Zn元素化合价升高,被氧化,Zn为负极反应,Mn元素化合价降低,被还原,MnO2为正极反应;
(5)阳极发生氧化反应,锰由+2价变成+4价;
(6)样品中二氧化锰与足量酸性KI溶液充分反应后,MnO2+2I-+2H+=Mn2++I2+H2O,配制成100mL溶液.取其中20.00mL,恰好与25.00mL 0.0800mol•L-1 Na2S2O3溶液反应(I2+2S2O32-═2I-+S4O62-),则得到:MnO2~I2~2S2O32-,据此分析计算.
解答 解:软锰矿的主要成分为MnO2,还含有Si、Fe、Al、Zn和Cu等元素的化合物,硫酸亚铁在酸性条件下将MnO2还原为MnSO4,所以酸浸后的滤液中的金属阳离子主要是Mn2+、Fe3+、Al3+、Cu2+、Zn2+、Fe2+等,由离子开始沉淀及沉淀完全的pH可知,调节pH为5.4,将Fe3+、Al3+沉淀,加入硫化锰将Cu2+、Zn2+沉淀,滤液为硫酸锰溶液,再通过系列变化得到高纯度的二氧化锰,
(1)FeSO4在反应条件下将MnO2还原为MnSO4,Fe2+被氧化为Fe3+,故酸浸时生成硫酸锰、硫酸铁,根据元素守恒还有水生成,反应方程式为2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O,
故答案为:2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O;
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能充分氧化过量的Fe2+,滤渣A的成分是Fe(OH)3、Al(OH)3,加入氨水需调节pH至少达到5.4,恰好能使Fe3+、Al3+沉淀完全,
故答案为:充分氧化过量的Fe2+;5.4;
(3)由题中硫化物的Ksp可知,加入MnS是为了生成溶解度更小的CuS、ZnS而除去Cu2+、Zn2+,滤渣B的成分是CuS、ZnS,
故答案为:CuS、ZnS;
(4)在反应中Zn元素化合价升高,被氧化,Zn为负极反应,负极电极反应式为Zn+2OH--2e-═Zn(OH)2,Mn元素化合价降低,被还原,MnO2为正极反应,正极反应式为MnO2+H2O+e-═MnOOH+OH-,
故答案为:MnO2+H2O+e-═MnOOH+OH-;
(5)阳极发生氧化反应,锰由+2价变成+4价,电极反应为Mn2++2H2O-2e-=MnO2+4H+,
故答案为:Mn2+-2e-+2H2O═MnO2+4H+;
(6)准确称量0.4600g该样品,与足量酸性KI溶液充分反应后,MnO2+2I-+2H+=Mn2++I2+H2O,配制成100mL溶液.取其中20.00mL,恰好与25.00mL 0.0800mol•L-1 Na2S2O3溶液反应(I2+2S2O32-═2I-+S4O62-),
则得到:MnO2~I2~2S2O32-,
1 2
n 0.025.00L×0.0800mol•L-1×$\frac{100ml}{20ml}$
n=0.005mol,
计算可得该样品MnO2纯度=$\frac{0.005mol×87g/mol}{0.4600g}$×100%=94.6%,
故答案为:94.6%;
点评 本题考查学生对元素及其化合物的主要性质的掌握、书写电极反应方程式、阅读题目获取新信息能力、对工艺流程的理解等,题目难度中等,需要学生具备扎实的基础与综合运用知识、信息分析解决问题能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下pH=7的溶液中:Fe3 +、Mg2 +、SO4 2-、Cl- 能大量共存 | |
| B. | 25℃时Ksp(AgCl)=1.8×10-10,向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度可能增大 | |
| C. | 浓度均为0.1 mol•L- 1 的下列溶液,pH由大到小的排列顺序为:NaOH>Na2 CO3>(NH4 )2 SO4>NaHSO4 | |
| D. | 常温下水电离出c(H+ )×c(OH- )=10-20 的溶液中:Na+、ClO-、SO42 -、NH4 + 可能大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S→SO3可以一步实验 | |
| B. | S是淡黄色固体,易溶于水 | |
| C. | Fe+S→FeS,Fe+Cl2→FeCl3,说明氧化性:Cl2>S | |
| D. | 试管壁上残留的S可以用酒精清洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用细铁丝代替铂丝做焰色反应实验 | |
| B. | 容量瓶使用前须烘干 | |
| C. | 可用CCl4将溴水中的溴单质分离除净 | |
| D. | 用元素分析仪确定物质中含有哪些金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | CO2通入NaClO 溶液中能生成HClO |
| B | 根据溶液的pH与溶液碱性的关系 | pH=6.8的溶液一定显酸性 |
| C | 组成和结构相似的物质,沸点随相对分子质量增大而升高 | H2O沸点低于H2S |
| D | 同主族元素从上至下非金属性减弱 | HF、HCl、HBr、HI的酸性依次减弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其它分散系的本质特征是分散质微粒直径在10-9 m~10-7m之间 | |
| B. | 用聚光手电筒照射CuSO4溶液和Fe(OH)3胶体时,产生的现象相同 | |
| C. | 将5-6滴饱和FeCl3溶液加入到沸水中继续加热至溶液呈红褐色制得了Fe(OH)3胶体 | |
| D. | Fe(OH)3胶体能够吸附水中悬浮的固体颗粒并沉降,达到净水目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极反应为:2H2+4OH--4e-═4H2O | |
| B. | 正极反应为:O2+4H++4e-═2 H2O | |
| C. | 电池工作时溶液中的阴离子移向正极 | |
| D. | 电池工作时负极区pH升高,正极区pH下降 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl | B. | Ba(OH)2 | C. | NH4Al(SO4)2 | D. | Na3PO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com