
【题目】Mg–AgCl电池是一种以海水为电解质溶液的水激活电池。下列叙述错误的是( )
A.正极反应式为Ag++e–═Ag
B.电池放电时Cl–由正极向负极迁移
C.负极反应式为Mg–2e–═Mg2+
D.负极会发生副反应Mg+2H2O═Mg(OH)2+H2↑
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】利用下面装置设计实验,制备SO2并进行探究。
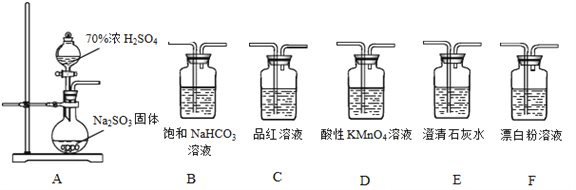
(1)装置A中反应的化学方程式:__________________。
(2)将A中产生的SO2持续通入装置G中直至过量。
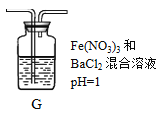
①G中有白色沉淀生成,其化学式为_________。
②写出反应初始时SO2被氧化的离子方程式:________________。
(3)选用A~F中的装置验证H2SO4的酸性强于H2CO3,能作为依据的实验现象是:________。
(4)要证明H2SO3的酸性强于HClO,所选装置(A~F中)的连接顺序为(填序号):A__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质性质与对应用途错误的是( )
A. Na2FeO4有强氧化性,还原产物又易水解成胶体,是自来水理想的消毒剂和净水剂
B. 晶体硅因熔点高硬度大,常用作芯片
C. 氮气的化学性质稳定,常用作粮食的保护气
D. AgBr有感光性,常用作胶片和太阳镜中的感光剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在已处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明平衡发生移动的是
A. 反应物的转化率 B. 反应混合物的浓度
C. 正、逆反应速率 D. 反应混合物的压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25℃和95℃时,其电离平衡曲线如右图所示:
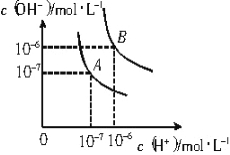
(1)则25℃时水的电离平衡曲线应为 (填“A”或“B”),请说明理由 。
(2)95℃时,若10体积pH1= a的某强酸溶液与1体积pH2= b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是__________________。
(3)25℃时,将pH = 11的NaOH溶液与pH = 4的H2SO4溶液混合,若所得混合溶液的pH = 10,则NaOH溶液与H2SO4溶液的体积比为__________________。
(4)曲线B对应温度下,pH = 2的某HA溶液和pH = 10的NaOH溶液等体积混合后,混合溶液的pH = 5。请分析其原因: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下离子或分子在溶液中能大量共存,且通入CO2后仍能大量共存的一组是
A. K+、Ca2+、Cl―、NO3― B. K+、Na+、Br―、SiO32
C. H+、Fe2+、SO42、Cl2 D. K+、Ag+、NH3·H2O、NO3―
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,空气之中少量的NO2能参与硫酸型酸雨的形成,反应过程如下:
①SO2+NO2=SO3+NO ②SO3+H2O=H2SO4 ③2NO+O2=2NO2 NO2在上述过程中的作用,与H2SO4在下列变化中的作用相似的是
A. 潮湿的氯气通过盛有浓H2SO4的洗气瓶 B. 硫化氢通入浓H2SO4中
C. 浓H2SO4滴入萤石中,加热 D. 加入少量H2SO4使乙酸乙酯水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类结果全部正确的是( )
A. 水煤气-混合物 胆矾-纯净物 臭氧-单质
B. 纯碱-碱 硫化氢-酸 小苏打-酸式盐
C. 油脂-高分子化合物 纤维素-天然高分子化合物 有机玻璃-合成高分子化合物
D. 液氯-非电解质 硫酸钡-强电解质 醋酸-弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,已知下列各反应为放热反应,下列各热化学方程式中ΔH最小的是
A. 2A(l)+B(l)==="2C(g)" ΔH1 B. 2A(g)+B(g)==="2C(l)"ΔH2
C. 2A(g)+B(g)==="2C(g)" ΔH3 D. 2A(l)+B(l)==="2C(l)" ΔH4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com