
 常用于除去高速公路冰雪的是“氯盐类”融雪剂,如NaCl、MgCl2等,请回答:
常用于除去高速公路冰雪的是“氯盐类”融雪剂,如NaCl、MgCl2等,请回答:| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2745 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
分析 (1)根据晶体的组成元素及性质分析晶体的类型;
(2)从是否形成氢键以及价层电子对的角度分析;
(3)根据第一至第四电离能的变化可判断出各元素的最高化合价,进而推断元素的种类,周期表中,同周期元素从左到右电负性逐渐增强;
(4)根据能量最低原理及洪特规则书写电子排布式;从N2的结构分析lCN+中π键数目.
解答 解:(1)NaC1、MgC12等为活泼金属与活泼非金属性形成的化合物,为离子晶体,
故答案为:离子晶体;
(2)由于O-H键的键长小于H-S键的键长,所以水的热稳定性高于硫化氢,硫化氢的分子中硫原子的价层电子对数为$\frac{6+2}{2}$=4,硫原子按sp3方式杂化,硫原子有两对孤电子对,所以硫化氢分子的空间构型为V形,
故答案为:O-H键的键长小于H-S键的键长;V形;
(3)从表中原子的第一至第四电离能可以看出,Z的第一电离能较小,而第二电离子能较大,说明易失去1个电子,则Z的化合价为+1价,应为Na元素,Y的第一、第二电离能较小,可失去2个电子,即最外层应有2个电子,应为Mg元素,而X的第一、第二、第三电离能都较小,可失去3个电子,最高化合价为+3价,应为Al元素,周期表中,同周期元素从左到右电负性逐渐增强,则X、Y、Z的电负性从大到小的顺序为Al、Mg、Na,因为元素Mg价电子排布式为3s2完全充满状态,比Al稳定,所以Mg的第一电离能大于Al,
故答案为:Al、Mg、Na;因为元素Mg价电子排布式为3s2完全充满状态,比Al稳定;
(4)①铁元素基态原子电子排布式为1s22s22p63s23p63d64s2,价电子排布式为3d64s2,
故答案为:3d64s2;
②N2中,N原子之间含有2个π键,已知CN-与N2结构相似,则1molCN-中π键数目为2NA,
故答案为:2NA;
③由配离子结构示意图可知黄血盐的化学式为K4[Fe(CN)6],则反应的化学方程式为Fe(CN)2+4KCN=K4[Fe(CN)6],
故答案为:Fe(CN)2+4KCN=K4[Fe(CN)6].
点评 本题考查原子、分子以及晶体的结构和性质,题目难度较大,本题注意把握电子排布式的书写、晶体类型的判断以及晶体结构的分析等方法性问题的总结和积累.


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:解答题
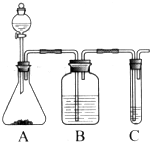 Ⅰ.实验室常用如图中的装置制备乙炔并检验乙炔的性质
Ⅰ.实验室常用如图中的装置制备乙炔并检验乙炔的性质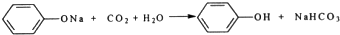 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻.G、H、I、J、K、L是常见化合物,其中G在常温下是无色无味的液体,H是黑色固体.以上物质相互间的转化关系如图所示,请回答下列问题:
A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻.G、H、I、J、K、L是常见化合物,其中G在常温下是无色无味的液体,H是黑色固体.以上物质相互间的转化关系如图所示,请回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | ①③④ | C. | ②④⑥ | D. | 只有⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与浓溴水反应(Fe作催化剂)制溴苯 | |
| B. | 乙醇、冰醋酸、稀硫酸共热制乙酸乙酯 | |
| C. | 氯乙烯加聚后的生成物使酸性KMnO4溶液褪色 | |
| D. | 甲酸甲酯能使新制Cu(OH)2在加热条件下产生红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质 | |
| B. | 在过程③中将MgCl2•6H2O灼烧即可制得无水MgCl2 | |
| C. | 在过程④、⑥反应中每氧化0.2 mol Br-需消耗2.24LCl2 | |
| D. | 过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(H+)随着温度的升高而降低 | |
| B. | 35℃时纯水中c(H+)═c(OH-) | |
| C. | 向水中加入NaHSO4溶液会抑制水的电离 | |
| D. | 向水中加入NaHCO3溶液会抑制水的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
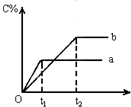 如图为A(气)+B(气)?nC(气)+Q在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线.下列有关叙述正确的是( )
如图为A(气)+B(气)?nC(气)+Q在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线.下列有关叙述正确的是( )| A. | 若其它条件相同,a比b的温度高 | |
| B. | a表示有催化剂,b表示无催化剂 | |
| C. | 若n=2,其它条件相同,a比b的压强大 | |
| D. | 反应由逆反应开始 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com