
【题目】某密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g) ΔH<0。如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法错误的是( )
2Z(g) ΔH<0。如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法错误的是( )
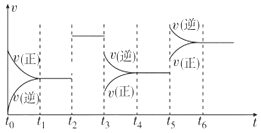
A.t2时加入了催化剂
B.t3时减小了压强
C.t5时升高了温度
D.t4~t5时间内X转化率最低
科目:高中化学 来源: 题型:
【题目】研究小组设计用含氯的有机物A合成棉织物免烫抗皱整理剂M的路线如下(部分反应试剂和条件未注明):
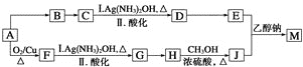
已知:①E的分子式为C5H8O4,能发生水解反应,核磁共振氢谱显示E分子内有2种不同化学环境的氢原子,其个数比为3∶1;
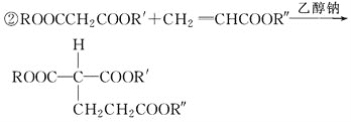
(R、R′、R″代表相同或不相同的烃基)。
(1)A分子中的含氧官能团的名称是________________。
(2)D→E反应的化学方程式是____________。
(3)A→B反应所需的试剂是________________。
(4)G→H反应的化学方程式是____________。
(5)已知1 mol E与2 mol J反应生成1 mol M,则M的结构简式是________。
(6)E的同分异构体有下列性质:①能与NaHCO3反应生成CO2;②能发生水解反应,且水解产物之一能发生银镜反应,则该同分异构体共有________种,其中任意1种的结构简式是________。
(7)J可合成高分子化合物,该高分子化合物的结构简式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将pH=12的NaOH溶液平均分成两份,一份加水V1 L,另一份加入与该NaOH溶液物质的量浓度相等的硫酸V2 L,pH都降低了1,则V1 :V2 为(溶液体积可以叠加)
A. 10 : 1 B. 11 : 1 C. 20 : 1 D. 21 : 1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式正确的是(注:![]() 的绝对值均正确)( )
的绝对值均正确)( )
A.C2H5OH(l)+3O2(g)=2CO2(g) +3H2O(g);△H= —1367.0 kJ/mol(燃烧热)
B.NaOH(aq) + HCl(aq)=NaCl(aq)+ H2O(l);△H= —57.3kJ/mol(中和热)
C.S(s) + O2(g) = SO2(g);△H= —269.8kJ/mol(反应热)
D.2HCl(g)=Cl2(g) + H2(g);△H= — 184.6kJ/mol(反应热)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:____。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按下图连接好装置进行实验。
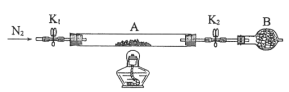
①仪器B的名称是____。
②将下列实验操作步骤正确排序____(填标号);重复上述操作步骤,直至A恒重,记为m3g。
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A
f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目x=____(列式表示)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
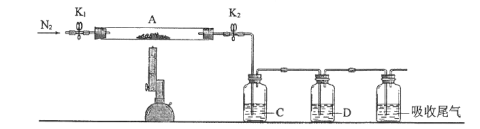
①C、D中的溶液依次为____(填标号)。C、D有气泡,并可观察到的现象分别为____。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】刚结束的两会《政府工作报告》首次写入“推动充电、加氢等设施的建设”。如图是一种正负电极反应均涉及氢气的新型“全氢电池”,能量效率可达80%。下列说法中错误的是
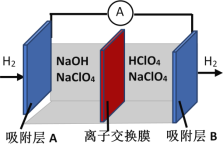
A. 该装置将化学能转换为电能
B. 离子交换膜允许H+和OH-通过
C. 负极为A,其电极反应式是H2-2e- + 2OH- = 2H2O
D. 电池的总反应为H+ + OH-![]() H2O
H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向硝酸酸化的2 mL 0.1 mol·L-1 AgNO3溶液(pH=2)中加入过量铁粉,振荡后静置,溶液先呈浅绿色,后逐渐呈棕黄色,试管底部仍存在黑色固体,过程中无气体生成。实验小组同学针对该实验现象进行了如下探究。
Ⅰ.探究Fe2+产生的原因。
(1)提出猜想:Fe2+可能是Fe与________或________反应的产物。(均填化学式)
(2)实验探究:在两支试管中分别加入与上述实验等量的铁粉,再加入不同的液体试剂,5 min后取上层清液,分别加入相同体积和浓度的铁氰化钾溶液。
液体试剂 | 加入铁氰化 | |
钾溶液 | ||
1号试管 | 2 mL 0.1 mol·L-1 | |
AgNO3溶液 | 无蓝色沉淀 | |
2号试管 | 硝酸酸化的2 mL 0.1 mol·L-1______溶液(pH=2) | 蓝色沉淀 |
①2号试管中所用的试剂为_________。
②资料显示:该温度下,0.1 mol·L-1 AgNO3溶液可以将Fe氧化为Fe2+。但1号试管中未观察到蓝色沉淀的原因可能为_______。
③小组同学继续进行实验,证明了由2号试管得出的结论正确。实验如下:取100 mL 0.1 mol·L-1硝酸酸化的AgNO3溶液(pH=2),加入铁粉并搅拌,分别插入pH传感器和NO![]() 传感器(传感器可检测离子浓度),得到图甲、图乙,其中pH传感器测得的图示为________(填“图甲”或“图乙”)。
传感器(传感器可检测离子浓度),得到图甲、图乙,其中pH传感器测得的图示为________(填“图甲”或“图乙”)。
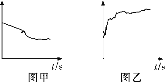
④实验测得2号试管中有NH4+生成,则2号试管中发生反应的离子方程式为__________。
Ⅱ.探究Fe3+产生的原因。
查阅资料可知,反应中溶液逐渐变棕黄色是因为Fe2+被Ag+氧化了。小组同学设计了不同的实验方案对此进行验证。
(3)方案一:取出少量黑色固体,洗涤后,______(填操作和现象),证明黑色固体中有Ag。
(4)方案二:按下图连接装置,一段时间后取出左侧烧杯中的溶液,加入KSCN溶液,溶液变红。该实验现象________(填“能”或“不能”)证明Fe2+可被Ag+氧化,理由为________。
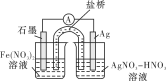
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有Na2CO3和NaHCO3两种白色固体物质:
Ⅰ.欲探究Na2CO3和NaHCO3稳定性的相对强弱,两同学分别设计了以下两组装置:
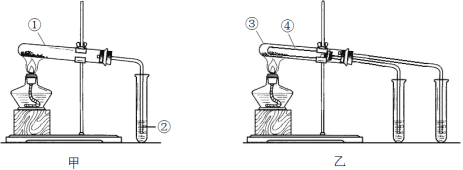
请回答:
①如甲图所示,分别用Na2CO3和NaHCO3做实验,试管②中的试剂是______(填字母序号)。
a. 稀H2SO4 b. NaOH溶液 c. Ca(OH)2溶液
②如乙图所示,试管④中装入的固体应该是______________(填化学式)。
③通过上述实验,得出的结论是:Na2CO3比NaHCO3的稳定性______(填“强”或“弱”)。
Ⅱ.欲鉴别两种固体物质可选用的试剂是_____________。
Ⅲ.等物质的量浓度的两种物质的溶液与同浓度的盐酸反应,反应速率快的是_________(填化学式)。
(2)甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气。请回答下列问题:
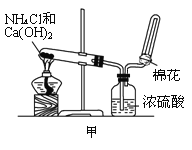
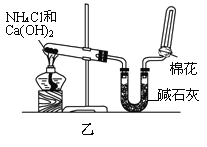
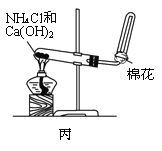
①实验室制取氨气的化学方程式为:________________________________________;
②三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨气(假设他们的实验操作都正确),你认为没有收集到氨气的同学是___________(填“甲”、“乙”或“丙”),收集不到氨气的主要原因是___________________________(用化学方程式表示);
③检验氨气是否收集满的方法是(简述操作方法、现象和结论)_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各图像的解释或结论正确的是( )
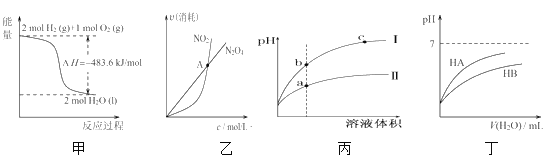
A.由甲可知:热化学方程式是H2(g)+![]() O2(g)=H2O(g)
O2(g)=H2O(g) ![]() H=-241.8kJ/mol
H=-241.8kJ/mol
B.由乙可知:对于恒温恒容条件下的反应2NO2(g)![]() N2O4(g),A点为平衡状态
N2O4(g),A点为平衡状态
C.由丙可知:相同pH的盐酸和醋酸溶液分别加水稀释,b点溶液的导电性比c点溶液的导电性强
D.由丁可知:同温度、同物质的量浓度的HA溶液与HB溶液相比,其pH前者小于后者
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com