
分析 (1)原电池中,失电子化合价升高的电极为负极、得电子化合价降低的电极是正极,该反应放电时生成氢氧化物,说明电解质溶液呈碱性;
(2)正极上NiO(OH)得电子发生还原反应;
(3)放电时,化学能转化为电能,充电时电能转化为化学能,放电过程实质上是发生氧化还原反应过程.
解答 解:(1)原电池中,失电子化合价升高的电极为负极、得电子化合价降低的电极是正极,根据电池反应式知,放电时Cd元素化合价由0价变为+2价、Ni元素化合价由+3价变为+2价,所以Cd是负极,该反应放电时生成氢氧化物,说明电解质溶液呈碱性,
故答案为:Cd;碱性;
(2)负极反应为Cd-2e-+2OH-=Cd(OH)2,正极上NiO(OH)得电子发生还原反应,正极上反应式为:NiOOH+e-+H2O═Ni(OH)2+OH-,
故答案为::NiOOH+e-+H2O═Ni(OH)2+OH-;
(3)放电时,化学能转化为电能,充电时电能转化为化学能,放电过程实质上是发生氧化还原反应过程,
故选ac.
点评 本题考查化学电源新型电池,为高频考点,明确原电池和电解池原理是解本题关键,难点是电极反应式的书写,注意原电池和电解池区别,题目难度不大.


科目:高中化学 来源: 题型:选择题
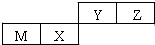
| A. | 原子半径Z>Y | |
| B. | Y的最高价氧化物对应水化物的酸性比X 的弱 | |
| C. | M和Y的最高价氧化物对应水化物之间能相互反应 | |
| D. | Y的气态氢化物比Z气态氢化物稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 54g H218O中含有电子总数为30NA个 | |
| B. | 11.2L H2中含有的电子数为NA个 | |
| C. | 23gNa+含有的最外层电子数为NA个 | |
| D. | 16g氧气和16g臭氧含有的核外电子总数均为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
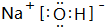 ,该化合物中所含的化学键有离子键、共价键.
,该化合物中所含的化学键有离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
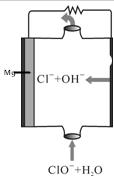
| A. | 电子由负极经电解质溶液移向正极 | |
| B. | ClO-参与的一极为正极 | |
| C. | 电池中镁为负极,发生氧化反应 | |
| D. | 放电过程中,溶液中Cl-的物质的量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 向碳酸钠溶液中滴入酚酞试液,加热 | 溶液红色加深 | 碳酸钠水解吸热 |
| B | NaAlO2溶液与NaHCO3溶液混合 | 有白色絮状沉淀生成 | 二者水解相互促进生成氢氧化铝沉淀 |
| C | 向Fe(NO3)2溶液中先滴入KSCN溶液再滴加盐酸 | 加入盐酸后溶液变成血红色 | Fe2+被盐酸氧化为Fe3+ |
| D | 向1mL0.1mol/LMgSO4溶液中滴入10mL等浓度的NaOH溶液,片刻后再滴加0.1mol/LCuSO4溶液 | 先有白色沉淀生成后变为蓝色沉淀 | Cu(OH)2的溶度积常数比Mg(OH)2的小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
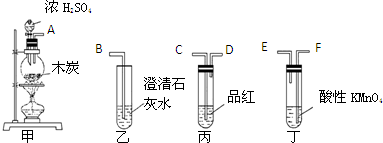
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com