
利用反应6NO2+8NH3===7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,下列说法不正确的是( )
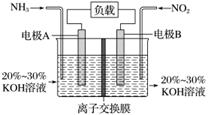
A.电流从右侧电极经过负载后流向左侧电极
B.为使电池持续放电,离子交换膜需选用阳离子交换膜
C.电极A极反应式为2NH3-6e-===N2+6H+
D.当有4.48 L NO2(标准状况)被处理时,转移电子为0.8 mol
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
阿斯匹林的结构简式为: 则1mol阿斯匹林跟足量氢氧化钠溶液
充分反应,消耗氢氧化钠的物质的量为
A、1mol B、2mol C、3mol D、4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)氢氧燃料电池以KOH溶液作电解质溶液时,工作一段时间后,电解质溶液的浓度将________,溶液的pH____________________________。(填“减小”、“增大”或“不变”)
(2)氢氧燃料电池以H2SO4溶液作电解质溶液时,工作一段时间后,电解质溶液的浓度将________,溶液的pH________。(填“减小”、“增大”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中的总反应方程式是:
Ni(OH)2+M===NiOOH+MH
已知:6NiOOH+NH3+H2O+OH-===6Ni(OH)2+NO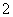
下列说法正确的是( )
A.NiMH电池放电过程中,正极的电极反应式为NiOOH+H2O+e-===Ni(OH)2+OH-
B.充电过程中OH-离子从阳极向阴极迁移
C.充电过程中阴极的电极反应式:H2O+M+e-===MH+OH-,H2O中的H被M还原
D.NiMH电池中可以用KOH溶液、氨水等作为电解质溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中不正确的是( )
A.由Al、Cu、稀H2SO4组成的原电池,负极反应式为Al-3e-===Al3+
B.由Mg、Al、NaOH溶液组成的原电池,负极反应式为Al-3e-+4OH-===AlO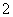 +2H2O
+2H2O
C.由Fe、Cu、FeCl3溶液组成的原电池,负极反应式为Cu-2e-===Cu2+
D.由Al、Cu、浓硝酸组成的原电池,负极反应式为Cu-2e-===Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)分析如图所示的四个装置,请回答下列问题:
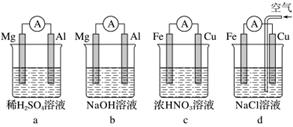
①装置a和b中铝电极上的电极反应式分别为________________________________________、________________________________________________________________________。
②装置c中产生气泡的电极为________电极(填“铁”或“铜”),装置d中铜电极上的电极反应式为____________________________________________________________。
(2)观察如图所示的两个装置,图1装置中铜电极上产生大量的无色气泡,图2装置中铜电极上无气体产生,而铬电极上产生大量的有色气体。根据上述现象试推测金属铬具有的两种重要化学性质为_________________________________、________________________________。
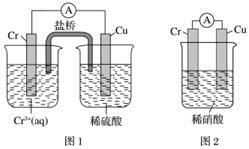
查看答案和解析>>
科目:高中化学 来源: 题型:
在25℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液。观察到的现象是先出现黄色沉淀,最终出现黑色沉淀。已知有关物质的溶度积Ksp (25℃)如下:
| AgCl | AgI | Ag2S | |
| Ksp(单位省略) | 1.8×10-10 | 1.5×10-16 | 6.3×10-50 |
下列叙述错误的是
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀容易转化为溶解度更小的沉淀
C.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解程度相同
D.25℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同
查看答案和解析>>
科目:高中化学 来源: 题型:
为了综合利用副产品CaSO4,某化工厂与相邻的合成氨厂联合设计了下列(NH4)2SO4生产流程:
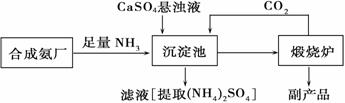
请回答以下问题:
(1)合成氨反应的化学方程式是 ,该反应在 (填设备名)中发生,反应所用催化剂一般用 。
(2)沉淀池中发生的主要反应方程式是 ,该反应能够发生的原因是 。
(3)在上述流程中可以循环使用的物质是 ,该生产过程中的副产品是 。
(4)从绿色化学和资源综合利用的角度说明上述流程的主要优点是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
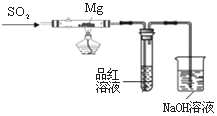 某兴趣小组依据CO2+2Mg=2MgO+C,推测Mg与SO2在隔绝空气条件下反应后,剩余固体M可能含有MgO、S、MgS、Mg中的一种或几种。为了验证推测,进行以下实验。请回答有关问题。
某兴趣小组依据CO2+2Mg=2MgO+C,推测Mg与SO2在隔绝空气条件下反应后,剩余固体M可能含有MgO、S、MgS、Mg中的一种或几种。为了验证推测,进行以下实验。请回答有关问题。
实验Ⅰ 按右图所示进行实验。
(1)实验前需除去镁条表面氧化膜。用简易的物理
方法除氧化膜的操作是 ;
(2)实验室制取二氧化硫的化学方程式为 ;
(3)上述装置存在不合理之处,请提出1项改进建议 ;
 (4)实验时,先通入SO2直到 现象出现后,再点燃酒精灯;此操作目的是 。
(4)实验时,先通入SO2直到 现象出现后,再点燃酒精灯;此操作目的是 。
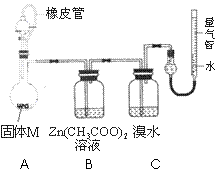
实验Ⅱ 确定固体M的成分。
实验装置如右图所示。将分液漏斗中稀硫酸(足量)
加入到烧瓶中,完全反应后,实验现象如下:
|
(5)实验时,B装置中反应的化学方程式为 ;
(6)已知镁的相对原子质量为24,则固体M中金属镁的质量为 g;实验前装置内有空气,对金属镁质量的测定结果的影响是 (填偏低、偏高、无影响);
(7)依以上实验,可确定固体M的成分有 种(填数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com