
 .
. ,ZW与水反应放出气体的化学方程式为NaH+H2O═NaOH+H2↑.
,ZW与水反应放出气体的化学方程式为NaH+H2O═NaOH+H2↑.分析 W、X、Y、Z、M、G六种元素分属三个短周期,原子序数依次增大,则W应为H元素,X元素的气态氢化物水溶液呈碱性,则X为N元素;Y、M同主族,可形成MY2、MY3两种分子,则M为S元素、Y为O元素,W、Z同主族,可形成离子化合物ZW,Z的原子序数小于S,应为Na元素,G原子序数大于S原子序数,则G为Cl元素,以此解答该题.
解答 解:(1)O元素在元素周期表中的位置为第二周期ⅥA族,上述元素的最高价氧化物对应的水化物酸性最强的是氯对应最高价氧化物的水化物HClO4,H、O、Na、S形成的简单离子的半径大小顺序是S2->O2->Na+>H+,氯离子结构示意图: ,故答案为:第二周期ⅥA族;HClO4;S2->O2->Na+>H+;
,故答案为:第二周期ⅥA族;HClO4;S2->O2->Na+>H+; ;
;
(2)O的非金属性大于S,非金属性越强氢化物越稳定,所以水稳定,故答案为:H2O;O的非金属性大于S;
(3)Z2Y2是过氧化钠,其电子式为 ,NaH与水反应生成氢氧化钠和氢气,反应方程式为:NaH+H2O═NaOH+H2↑,
,NaH与水反应生成氢氧化钠和氢气,反应方程式为:NaH+H2O═NaOH+H2↑,
故答案为: ;NaH+H2O═NaOH+H2↑;
;NaH+H2O═NaOH+H2↑;
(4)肼-空气燃料电池是一种碱性燃料电池工作时,负极上肼失电子发生氧化反应,电极反应式为N2H4-4e-+4OH-═N2↑+4H2O,正极上发生得电子的还原反应,即2H2O+O2+4e-═4OH-,溶液中OH-离子向负极,故答案为:N2H4-4e-+4OH-═N2↑+4H2O;负.
点评 本题考查结构性质位置关系应用,为高频考点,涉及半径比较、元素周期律、原电池、元素化合物推断等,推断元素是解题关键,注意对基础知识的理解掌握,难度中等.


科目:高中化学 来源: 题型:选择题
| 金属(粉末状)/mol | 酸的浓度和体积(mL) | 反应温度 | |||
| A | Mg | 0.1 | 1.5mol/L H2SO4 | 10 | 20℃ |
| B | Al | 0.1 | 3mol/L HCl | 10 | 20℃ |
| C | Zn | 0.1 | 3mol/L CH3COOH | 10 | 20℃ |
| D | Fe | 0.1 | 3mol/L HNO3 | 10 | 20℃ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
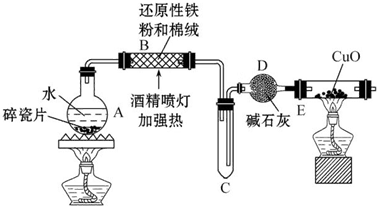
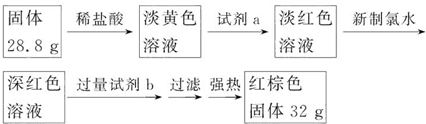
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3s2 3p3 | B. | 4s2 | C. | 4s2 4p1 | D. | 3s2 3p5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将Na2O2固体投入滴加了少许酚酞的蒸馏水中,溶液先变红后褪色 | |
| B. | 向胆矾晶体(CuSO4•5H2O)滴加浓硫酸,晶体由蓝色变为黑色 | |
| C. | 用玻璃棒蘸取浓硝酸滴加到pH试纸上,试纸先变红后变成白色 | |
| D. | 将SO2通入品红溶液中,溶液颜色褪去,加热后又变成红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
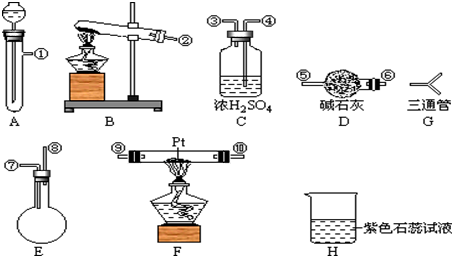
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
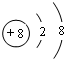 ,D在元素周期表中的位置第二周期VIA族.
,D在元素周期表中的位置第二周期VIA族.  .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁片作为负极 | B. | 正极发生氧化反应 | ||
| C. | 电池工作时镁片逐渐被消耗 | D. | 食盐水作为电解质溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com