
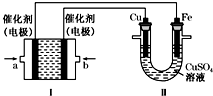
 回答下列问题:
回答下列问题:分析 (1)氧化热化学方程式和盖斯定律计算得到所需热化学方程式;
(2)①装置Ⅰ为乙醇燃料电池,电解质溶液为KOH溶液,乙醇在原电池负极失电子发生氧化反应,碱性环境中生成碳酸钾,氧气在正极得到电子生成氢氧根离子;
②装置Ⅱ为电解池,依据电解反应计算电子转移,结合电子守恒计算消耗乙醇的质量;
解答 解:(1)①CH4(g)+CO2(g)═2CO(g)+2H2(g);△H=+260kJ•mol-1
②2CO2(g)═2CO(g)+O2(g);△H=+582kJ•mol-1
氧化盖斯定律计算①×2-②得到CH4与O2反应生成CO和H2的热化学方程式为:2CH4(g)+O2(g)═2CO(g)+4H2(g);△H=-62 kJ•mol-1 ,
故答案为:2CH4(g)+O2(g)═2CO(g)+4H2(g);△H=-62 kJ•mol-1 ;
(2)①通过装置Ⅱ实现铁棒上镀铜,则装置Ⅱ中铜做电解池阳极,铁做电解池阴极,与铜相连的b电极为原电池正极,b处通入的是氧气,与铁相连的a电极为原电池的负极,a电极发生的反应是乙醇失电子发生氧化反应,阴极电子守恒、电荷守恒和原子守恒写出电极反应为:C2H5OH-12e-+16OH-=2CO32-+11H2O,
故答案为:O2,C2H5OH-12e-+16OH-=2CO32-+11H2O;
②在此过程中若完全反应,装置Ⅱ中阴极质量变化19.2g,电极反应Cu2++2e-=Cu,阴极质量变化增大质量为铜的质量,物质的量=$\frac{19.2g}{64g/mol}$=0.3mol,电子转移0.6mol,装置Ⅰ中电极反应C2H5OH-12e-+16OH-=2CO32-+11H2O,电子转移0.6mol,消耗乙醇0.05mol,理论上消耗乙醇质量=0.05mol×46g/mol=2.3g,
故答案为:2.3;
点评 本题涉及电化学、热化学等知识,注意知识的归纳和整理是关键,综合性强,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 X、Z、Q、R、T为前四周期元素,且原子序数依次增大.X和Q属同族元素,X和R可形成化合物XR4;R2为黄绿色气体;Z与X同周期且基态原子的s轨道和p轨道的电子总数相等;T2+的3d 轨道中有5个电子.请回答下列问题:
X、Z、Q、R、T为前四周期元素,且原子序数依次增大.X和Q属同族元素,X和R可形成化合物XR4;R2为黄绿色气体;Z与X同周期且基态原子的s轨道和p轨道的电子总数相等;T2+的3d 轨道中有5个电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 的混合物与金属钠反应,生成的烷烃不可能是( )
的混合物与金属钠反应,生成的烷烃不可能是( )| A. | CH3CH2CH2CH3 | B. | CH3CH2CH2CH2CH3 | C. | (CH3)2CHCH2CH2CH3 | D. | CH3CH2CH(CH3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有大量的氯气泄漏时,用肥皂水浸湿软布蒙面,并迅速离开现场 | |
| B. | 氢气在盛有氯气的集气瓶中燃烧,瓶口有白烟产生 | |
| C. | 氯气能与铁反应,液氯不宜贮存在钢瓶中 | |
| D. | 工业上以氯气和澄清石灰水为原料制造漂白粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有下列电子排布式的原子中,①1s22s22p63s23p2 ②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4 原子半径最大的是① | |
| B. | 具有下列最外层电子排布式的原子中,①3s23p1 ②3s23p2 ③3s23p3 ④3s23p4第一电离能最大的是③ | |
| C. | ①Na、K、Rb ②N、O、S ③Si、P、As ④Na、P、Cl,元素的电负性随原子序数增大而递增的是④ | |
| D. | 某元素基态原子的逐级电离能分别为578、1817、2745、11575、14830、18376、23293,当它与氯气反应时可能生成的阳离子是X2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 切开的金属Na暴露在空气中,光亮表面逐渐变暗2Na+O2═Na2O2 | |
| B. | 少量铜片放入浓硝酸中,有红棕色气体生成:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| C. | Na2O2在潮湿的空气中放置一段时间,变成白色粘稠物2Na2O2+2CO2═2Na2CO3+O2 | |
| D. | 向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 |
| A | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体 |
| B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝并不滴落, 好像有一层膜兜着 |
| C | 点燃的镁条伸入盛有O2的集气瓶(底部铺有少量细砂)中 | 镁条继续燃烧,发出耀眼白光放出大量热量,生成白色固体 |
| D | 在空气中久置的铝条放入NaOH溶液中 | 立刻产生大量无色气泡,铝条逐渐变细, 铝条逐渐发热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由非极性键构成的非极性分子 | B. | 中心原子的杂化方式是sp2 | ||
| C. | 该分子的空间构型是平面三角形 | D. | 1mol该分子有2mol σ键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com