
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:阅读理解
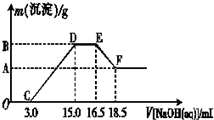 镁、铝、铁及其化合物在生产和生活中有广泛的应用.
镁、铝、铁及其化合物在生产和生活中有广泛的应用.| 实验序号 | I | II | III |
| 加入钢样粉末的质量(g) | 2.812 | 5.624 | 8.436 |
| 生成气体的体积(L)(标准状况) | 1.120 | 2.240 | 2.800 |
| 0.12 |
| 28.12 |
| 0.12 |
| 28.12 |
查看答案和解析>>
科目:高中化学 来源:2015届河南安阳一中高一月考(主校)化学试卷(解析版) 题型:选择题
n克的H2SO4所含氧原子的物质的量是
A.n/98 moL B.7n/98 moL C.4n/98 moL D.4n/32 moL
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河南安阳一中高一月考(主校)化学试卷(带解析) 题型:单选题
n克的H2SO4所含氧原子的物质的量是
| A.n/98 moL | B.7n/98 moL | C.4n/98 moL | D.4n/32 moL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com