
某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
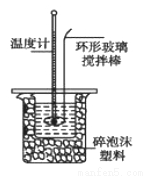
Ⅰ.配制0.50 mol/L NaOH溶液
若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体_____g。
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
(1)写出该反应的热化学方程式(中和热为57.3 kJ/mol):_____________。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | |||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ______ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热△H=______________取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是:______。
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
科目:高中化学 来源:2016-2017学年山西省大同市高二2月月考化学试卷(解析版) 题型:选择题
2008年10月8日,美籍华裔科学家钱永健获得2008年度诺贝尔化学奖。16岁时,他凭借一个金属易受硫氰酸盐腐蚀的调查项目,荣获“美国西屋科学天才奖”。下列叙述正确的是( )
A. 金属腐蚀就是金属失去电子被还原的过程
B. 合金的熔点都高于它的成分金属,合金的耐腐蚀性也都比其成分金属强
C. 铜板上的铁铆钉处在潮湿的空气中直接发生反应:Fe-3e-= Fe3+,继而形成铁锈
D. 将水库中的水闸(钢板)与外加直流电源的负极相连,正极连接到一块废铁上可防止水闸被腐蚀
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三下学期期初考试化学试卷(解析版) 题型:选择题
已知:CO(g)+H2O(g) CO2(g)+H2(g) △H=-41kJ•mol-1相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应.相关数据如下:
CO2(g)+H2(g) △H=-41kJ•mol-1相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应.相关数据如下:
容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
CO | H2O | CO2 | H2 | ||
① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
② | 0 | 0 | 1 | 4 | 热量变化:Q |
下列说法中正确的是
A. 容器①中反应达平衡时,CO的转化率为80%
B. 平衡时,若向容器①中再加入0.2molCO和0.2molCO2,则V正<V逆
C. Q=8.2
D. 容器①中CO的转化率与容器②中CO2的转化率之和为1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州省凯里市高二下学期开学考试理综化学试卷(解析版) 题型:简答题
汽车尾气中含有上百种不同的化合物,其中的污染物有固体悬浮颗粒、一氧化碳、二氧化碳、碳氢化合物、氮氧化合物、铅及硫氧化合物等,一辆轿车一年排放的有害废气比自身重量大3倍。其中NO气体是由于内燃机燃烧的高温引起N2和O2反应所致:N2(g)+O2(g) 2NO(g) △H>0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
2NO(g) △H>0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)某温度下,向4L密闭容器中充入N2和O2各4mol,平衡时,5分钟后O2的物质的量为1mol,则N2的反应速率是____________。
(2)恒容条件下,判断该反应达到平衡的标志是________。(填字母序号)。
A.消耗1mol N2同时生成1mol O2 B.混合气体密度不变
C.混合气体平均相对分子质量不变 D.2v(N2)正=v(NO)逆
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是________(填字母序号)。
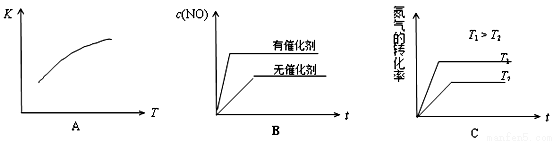
(4)可逆反应N2(g)+O2(g) 2NO(g)的平衡常数表达式为____________。温度升高,平衡常数将会
2NO(g)的平衡常数表达式为____________。温度升高,平衡常数将会
_____________(填“增大、或“减小”)
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol·L-1、4.0×10-2mol·L-1和3.0×10-3mol·L-1,此时反应___________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”)。
(6) 火箭燃料N2H4(肼)在NO2中燃烧,生成N2、液态水。已知:
N2(g)+2O2(g)=2NO2(g) △H1=+67kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(l) △H2=-534kJ/mol
由此请写出发射火箭时燃烧反应的热化学方程式____________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州省凯里市高二下学期开学考试理综化学试卷(解析版) 题型:选择题
目前有四个实验方案,可行的是
A. 除去混在Cu粉中的少量Mg粉和Al粉,加稀盐酸后过滤
B. 分离汽油和煤油 ,可用萃取的方法
C. 分离硝酸钾和氯化钠固体的混合物,可用溶解、过滤的方法
D. 将氧气和氢气的混合气体通过灼热的氧化铜,以除去其中的氢气
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二下学期开学考试化学试卷(解析版) 题型:选择题
将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 2C(g)。若经2s后测得C的浓度为0.6mol/L,现有几种说法:
2C(g)。若经2s后测得C的浓度为0.6mol/L,现有几种说法:
①用物质A表示的反应的平均速率为0.3 mol/(L·s)
②用物质B表示的反应的平均速率为0.6 mol/(L·s )
③2s时物质A的转化率为70% ④2s时B物质的浓度为0.7 mol/L
其中正确的是( )
A. ①③ B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三下学期开学考试化学试卷(解析版) 题型:选择题
下列实验装置应用于铜与浓硫酸反应制取二氧化硫和硫酸铜晶体,能达到实验目的的是( )
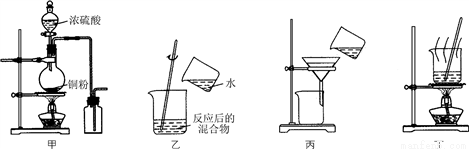
A. 用图甲装置制取并收集二氧化硫
B. 用图乙装置向反应后的混合物中加水稀释
C. 用图丙装置过滤出稀释后混合物中的不溶物
D. 用图丁装置将硫酸铜溶液蒸发浓缩后冷却结晶
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三下学期开学考试化学试卷(解析版) 题型:选择题
下列实验操作简便、科学且易成功的是( )
A. 将乙酸和乙醇的混合液注入浓硫酸中制备乙酸乙酯
B. 将铜丝在酒精灯外焰上加热变黑后再移至内焰,铜丝恢复原来的红色
C. 在试管中注入2 mL CuSO4溶液,再滴几滴NaOH溶液后,加入乙醛溶液即有红色沉淀生成
D. 向苯酚溶液中滴加几滴稀溴水出现白色沉淀
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆兵团第二师华山中学高二下学期学前考试化学试卷(解析版) 题型:选择题
有关热化学方程式书写与对应表述均正确的是( )
A. 已知2C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1, 则可知C的标准燃烧热为110.5 kJ·mol-1
B. 在101KPa下氢气的标准燃烧热△H =-285.5 kJ·mol则水分解的热化学方程式: 2H2O(l)=2H2(g)+O2(g) △H = +285.5 kJ·mol-1
C. 稀硫酸与0.1 mol/LNaOH溶液反应:H+(aq)+OH-(aq) = H2O(l) △H = -57.3 kJ·mol-1
D. 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量。则Fe(s)+S(g)=FeS(s) △H= - 95.6 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com