
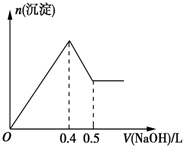
 现有AlCl3和MgSO4混合溶液,向其中不断加入0.1mol/L的NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为( )
现有AlCl3和MgSO4混合溶液,向其中不断加入0.1mol/L的NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为( )| A. | 6:1 | B. | 2:3 | C. | 1:3 | D. | 3:1 |
分析 由图可知加入0.4molNaOH时沉淀达最大量,沉淀为Mg(OH)2、Al(OH)3,根据氢氧根守恒可知2n[Mg(OH)2]+3n[Al(OH)3]=n(OH-),加入0.5mL NaOH时,沉淀由最大值变为为最小值,故0.1molNaOH恰好溶解氢氧化铝沉淀,根据反应Al(OH)3+NaOH=NaAlO2+2H2O可计算出n[Al(OH)3],再计算出n[Mg(OH)2],进而计算原溶液中Cl-与SO42-的物质的量浓度之比.
解答 解:由图可知加入0.4molNaOH时沉淀达最大量,沉淀组成为Mg(OH)2、Al(OH)3,根据氢氧根守恒可知2n[Mg(OH)2]+3n[Al(OH)3]=n(OH-)=0.4mol,
加入0.5molNaOH时,沉淀由最大值减小为最小值,故0.1molNaOH恰好完全溶解氢氧化铝沉淀,根据反应Al(OH)3+NaOH=NaAlO2+2H2O可知,n[Al(OH)3]=n(NaOH)=0.1mol,
所以n[Mg(OH)2]=$\frac{0.4mol-0.1mol×3}{2}$=0.05mol,
溶液中n(Cl-)=3n[Al(OH)3]=0.3mol,原溶液中n(SO42-)=n[Mg(OH)2]=0.05mol,
所以原溶液中Cl-与SO42-的物质的量之比为0.3mol:0.05mol=6:1,
故选A.
点评 本题考查离子方程式的有关计算,题目难度中等,明确图象中各阶段发生的反应原理为解答关键,注意掌握守恒思想在化学计算中的应用,试题考查了学生的分析、理解能力及化学计算能力.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:选择题
| X | Y | |
| Z | W |
| A. | 原子半径:Z>X>Y | |
| B. | Y的最高正价与最低负价的和是4 | |
| C. | W的单质是工业制取盐酸的原料之一 | |
| D. | X、W的氢化物相遇会产生白烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
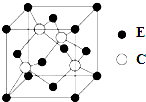 A、B、C、D、E为原子序数依次增大的四种元素,A的价电子层中的未成对电子有3个,B的最外层电子数为其内层电子数的3倍,C、D为同周期元素,C元素基态原子的3p轨道上有4个电子,D元素最外层有一个未成对电子,E位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.回答下列问题:
A、B、C、D、E为原子序数依次增大的四种元素,A的价电子层中的未成对电子有3个,B的最外层电子数为其内层电子数的3倍,C、D为同周期元素,C元素基态原子的3p轨道上有4个电子,D元素最外层有一个未成对电子,E位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Fe3+)=0.1mol•L -1的溶液中:K+、NH4+、CO32-、SO42-能共存 | |
| B. | 与Al反应产生H2的溶液中,NO3-、Na+、SO42-、Fe2+一定不共存 | |
| C. | NaClO溶液中通入少量SO2:2ClO-+SO2+H2O═SO32-+2HClO | |
| D. | 用铜作电极电解NaCl溶液:2H2O+2Cl-$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 悬浮物由黑色变为白色,因SO2是一种漂白剂 | |
| B. | 悬浮物由黑色变为白色,因为形成了PbSO4 | |
| C. | 有黄色沉淀生成 | |
| D. | 有臭鸡蛋味的气体放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
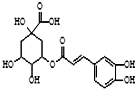 金银花的有效成分为绿原酸,具有广泛的杀菌、消炎功能,其结构简式如图.
金银花的有效成分为绿原酸,具有广泛的杀菌、消炎功能,其结构简式如图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H2、C2H4 | B. | C2H4、C3H6 | C. | C2H6、C3H8 | D. | CH4、C2H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com