
【题目】下列曲线表示卤族元素某种性质随核电荷数的变化趋势,正确的是
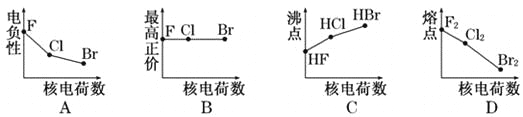
A. A B. B C. C D. D
【答案】A
【解析】试题分析:A.对于卤素来说,随着核电荷数的增大,元素的原子半径逐渐增大,原子获得电子的能力逐渐减小,元素电负性逐渐减小,A正确;B.卤素原子最外层电子数相同,但由于F的非金属性最强,与其他元素形成化合物时,不可能失去电子,因此F没有与族序数相等的最高正化合价,B错误;C.一般情况下,同一主族的元素形成的化合物结构相似,相对分子质量越大,分子之间的作用力就越大,物质的熔沸点就越高。但是在HF的分子之间除存在分子间作用力外,还存在氢键,增加了分子之间的吸引力,使其熔沸点比HBr、HI还高,C错误;D.卤素单质都是由分子构成的物质,相对分子质量越大,分子间作用力就越大,克服分子间作用力使物质的熔化或气化消耗的能量就越高。即物质的熔沸点就越高,D错误。答案选A。


科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图所示。若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )
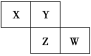
A. X的最常见气态氢化物的水溶液显酸性
B. 最高价氧化物对应水化物的酸性W比Z强
C. Z的单质与氢气反应比Y单质与氢气反应容易
D. X的原子半径小于Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)和铜(Cu)在生产生活中有广泛的应用。硒可以用作光敏材料、电解锰行业的催化剂,也是动物体必需的营养元素和对植物有益的营养元素等。氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下所示:
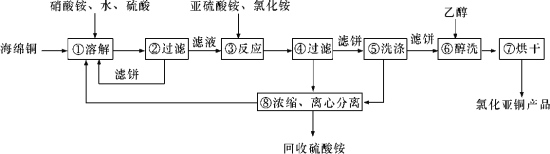
请回答下列问题:
(1)若步骤①中得到的氧化产物只有一种,则它的化学式是____________。
(2)写出步骤③中主要反应的离子方程式:_________。
(3)步骤⑤包括用pH=2的溶液酸洗、水洗两步操作,酸洗采用的酸是_______(写酸的名称)。
(4)上述工艺中,步骤⑥和⑦的作用是__________。
(5)Se为ⅥA族元素,用乙二胺四乙酸铜阴离子水溶液和硒代硫酸钠(Na2SeSO3)溶液反应可获得纳米硒化铜,硒代硫酸钠还可用于Se的精制,写出硒代硫酸钠(Na2SeSO3)与H2SO4溶液反应得到精硒的化学方程式:______________。
(6)氯化亚铜产率与温度、溶液pH关系如下图所示。据图分析,流程化生产氯化亚铜的过程中,温度过低影响CuCl产率的原因是_________;温度过高、pH过大也会影响CuCl产率的原因是____________。
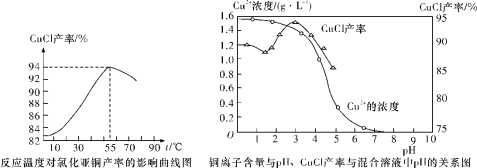
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol1
C(s)+1/2O2(g)=CO(g) ΔH=-111 kJ·mol1
该催化重整反应的ΔH==______ kJ·mol1。有利于提高CH4平衡转化率的条件是____(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______mol2·L2。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。
相关数据如下表:
积碳反应 CH4(g)=C(s)+2H2(g) | 消碳反应 CO2(g)+C(s)=2CO(g) | ||
ΔH/(kJ·mol1) | 75 | 172 | |
活化能/ (kJ·mol1) | 催化剂X | 33 | 91 |
催化剂Y | 43 | 72 | |
①由上表判断,催化剂X____Y(填“优于”或“劣于”),理由是_________________。在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是________填标号)。

A.K积、K消均增加 B.v积减小,v消增加
C.K积减小,K消增加 D.v消增加的倍数比v积增加的倍数大
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________________。
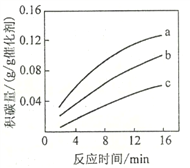
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)可用作分析试剂、基准试剂、还原剂、除氯剂等。
Ⅰ、实验室制备硫代硫酸钠装置图如下。

(1)仪器B的名称是________。
(2)写出装置B制备Na2S2O3的化学反应方程式____________________________。
(3)NaOH溶液的作用是____________________________________。
Ⅱ、测硫代硫酸钠样品纯度步骤如下
①称取Ⅰ中制得硫代硫酸钠样品8.0g配成250mL溶液
②从①中量取20.00mL溶液于锥形瓶中
③用0.lmol·L-1标准碘液滴定,实验测得数据如下
滴定前读数(mL) | 滴定后读数(mL) | 待测液体积(mL) | |
实验一 | 1.20 | 21.00 | 20.00 |
实验二 | 0.40 | 19.20 | 20.00 |
实验三 | 0.50 | x | 20.00 |
(4)该滴定时,向锥形瓶中加入1至2滴淀粉液作指示剂,则达到滴定终点的判断标准是______________。
(5)x读数如图所示,则x=________,根据所测的数据计算该硫代硫酸钠样品纯度为_______________。(已知I2+2Na2S2O3=2NaI+Na2S4O6)
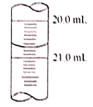
(6)若步骤①中量取20.00mL硫代硫酸钠溶液时,未用硫代硫酸钠溶液润洗滴定管,则测得样品的纯度将______________(填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A~M有如图转化关系,A与F分子中含碳原子数相同,均能与NaHCO3溶液反应,且A中含一个卤素原子,F的分子式为C9H10O2;D能发生银镜反应;M与NaOH溶液反应后的产物,其苯环上一氯代物只有一种。

已知:![]() (R1、R2代表烃基或氢原子)
(R1、R2代表烃基或氢原子)
请回答:
(1)B、F的结构简式分别为__________、_________
(2)反应①~⑦中,属于消去反应的是_____________(填反应序号)。
(3)D发生银镜反应的化学方程式为______________;反应⑦的化学方程式为__________
(4)A的相对分子质量在180~260之间,从以上转化中不能确认A中含有哪种卤素原子,确定该官能团的实验步骤和现象为_____________
(5)符合下列条件F的同分异构体共有________种。
a.能发生银镜反应
b.能与FeCl3溶液发生显色反应
c.核磁共振氢谱上有四个峰,其峰面积之比为1∶1∶2∶6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质结构与性质自然界中存在大量的金属元素,其中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用。
(1)请写出Fe的基态原子核外电子排布式__________。
(2)金属A的原子只有3个电子层,其第一至第四电离能如下:

则A原子的价电子排布式为__________________。
(3)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(Ⅰ)溶液来吸收原料气体中的CO(Ac-代表CH3COO-),其反应是:[Cu(NH3)2]Ac+CO+NH3![]() [Cu(NH3)3CO]Ac ΔH<0。 配合物[Cu(NH3)3CO]Ac中心原子的配位数为__________。
[Cu(NH3)3CO]Ac ΔH<0。 配合物[Cu(NH3)3CO]Ac中心原子的配位数为__________。
(4)NaCl和MgO都属于离子化合物,NaCl的熔点为801.3 ℃,MgO的熔点高达2800 ℃。造成两种晶体熔点差距的主要原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示。下列说法错误是

A. Q位于第三周期IA族
B. X、Y、Z三种元素组成的化合物可能是盐或碱
C. 简单离子半径:M->Q+>R2+
D. Z与M的最高价氧化物对应水化物均为强酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com