
【选修2:化学与技术】(15分)
空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
(1)步骤④的离子反应方程式为 。
(2)溴微溶于水,步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,它们的相对密度相差较大。分离出液溴的实验室方法为 。
(3)步骤⑥如果在实验室中进行,需用到的玻璃仪器有 。
(4)工业生产不直接蒸馏含溴的海水得到液溴,而要经过“空气吹出、SO2吸收、氯化”,原因是 。
(5)苦卤水还可以用于制取金属镁,用化学方程式表示从苦卤水制取金属镁的反应原理 。
(1)Br2 + SO2 + 2H2O === 4H+ + 2Br-+ SO42- (2分)(2)分液 (2分)
(3)酒精灯、蒸馏烧瓶、温度计、冷凝管、尾接管、锥形瓶 (3分)
(4)①氯化后的海水虽然含有溴单质,但浓度低,如果直接蒸馏原料,产品成本高
②“空气吹出、SO2吸收、氯化”的过程实际上是一个Br2的浓缩过程。(2分,
(5)MgCl2+Ca(OH)2 ="==" Mg(OH)2↓+CaCl2 (2分)2HCl+Mg(OH)2 ="==" MgCl2+2H2O (2分)
MgCl2(熔融)  Mg+Cl2↑(2分)
Mg+Cl2↑(2分)
解析试题分析:(1)步骤④的离子反应方程式为Br2 + SO2 + 2H2O === 4H+ + 2Br-+ SO42-;(2)溴微溶于水,步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,它们的相对密度相差较大。分离互不相溶的两层液体物质的操作方法是分液;(3)步骤⑥如果在实验室中进行,需用到的玻璃仪器有酒精灯、蒸馏烧瓶、温度计、冷凝管、尾接管、锥形瓶;(4)工业生产不直接蒸馏含溴的海水得到液溴,而要经过“空气吹出、SO2吸收、氯化”,原因是①氯化后的海水虽然含有溴单质,但浓度低,如果直接蒸馏原料,产品成本高;②“空气吹出、SO2吸收、氯化”的过程实际上是一个Br2的浓缩过程。(5)苦卤水还可以用于制取金属镁,用化学方程式表示从苦卤水制取金属镁的反应原理是MgCl2+Ca(OH)2 ="==" Mg(OH)2↓+CaCl2;2HCl+Mg(OH)2 ="==" MgCl2+2H2O;MgCl2(熔融) Mg+Cl2↑。
Mg+Cl2↑。
考点:考查“海水提溴”的原理、操作等知识及苦卤水制取金属镁的反应原理的方程式的表示的知识。


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:单选题
下列金属冶炼的反应原理,错误的是( )
A.2NaCl(熔融) 2Na+Cl2↑ 2Na+Cl2↑ | B.MgO+H2 Mg+H2O Mg+H2O |
C.Fe2O3+3CO 2Fe+3CO2 2Fe+3CO2 | D.2HgO 2Hg+O2↑ 2Hg+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法中,不正确的是
| A.用蒸馏法能从海水中提取淡水 |
| B.从海水中可以得到氯化镁,再加热分解可制金属镁 |
| C.用氯气从海水中提溴的关键反应是Cl2+2Br-= 2Cl-+Br2 |
D.煤的气化主要反应是 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
[化学选修——2:化学与技术](15分)
将海水淡化和与浓海水资源化结合起来是综合利用海水的重要途径之一。一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺提取其他产品。
回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是 (填序号)。
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾.溴.镁的提取工艺
(2)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收。碱吸收溴的主要反应是:Br2+Na2CO3+H2O  NaBr + NaBrO3+6NaHCO3,吸收1mol Br2时转移的电子为 mol。
NaBr + NaBrO3+6NaHCO3,吸收1mol Br2时转移的电子为 mol。
(3)海水提镁的一段工艺流程如下图:
浓海水的主要成分如下:
该工艺过程中,脱硫阶段主要反应的离子方程式为 ,产品2的化学式为 ,1L浓海水最多可得到产品2的质量为 g。
(4)采用石墨阳极.不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为 ;电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
目前世界上60%的镁是从海水中提取的。海水提镁的主要流程如下:
请回答下列问题:
(1)从离子反应的角度思考,在海水中加入石灰乳的作用是 ,写出在沉淀池中发生反应的离子方程式 。
(2)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度,生产生石灰的主要原料来源于海洋中的 。
(3)操作A是 ,操作B是 。
(4)加入的足量试剂a是 (填化学式)。
(5)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为 。从考虑成本和废物循环利用的角度,副产物氯气可以用于 。
(6)海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?
_____________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
我国有丰富的天然气资源。以天然气为原料合成尿素的主要步骤如下图所示(图中某些转化步骤及生成物未列出):
请填写下列空白:
(1)已知0.5 mol甲烷和0.5 mol水蒸气在t ℃、p kPa时,完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量。该反应的热化学方程式是___________。
(2)上述流程中,工业上分离H2、CO2合理的方法是_____________________。
| A.混合气先通入氢氧化钠溶液,再在溶液中加盐酸 |
| B.混合气加压冷却,使CO2液化 |
| C.混合气用氨水洗涤 |
| D.混合气先通入到石灰浆,然后高温煅烧固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
锌锰废电池经处理后,生产并回收硫酸锌及碳酸锰,其中生产工业级碳酸锰工艺如下:
试回答下列问题:
(1)锰在元素周期表中位于第________周期,第________族。
(2)步骤1和步骤2是将MnO2转化为MnO并溶于硫酸,其中步骤2中的氢气,是另一个流程产生的副产品,请写出产生氢气的反应方程式__________________________。
(3)步骤3和步骤4都是除杂质。
①X是一种“绿色”氧化剂,则X是________(填化学式)。
②步骤3是除去杂质Fe2+。请用文字和必要的方程式简述除去Fe2+的方法(已知三种离子沉淀的pH范围为Fe3+:2.7~3.7,Mn2+:8.6~10.1,Fe2+:7.6~9.6)_________________________________________________________。
③步骤4中主要反应方程式为:MeSO4+BaS=MeS↓+BaSO4↓(Me主要为Pb、Cd、Hg等),则其除去杂质的原理是_________________________________________________。
(4)已知进行步骤5的操作时,溶液3(主要成分为MnSO4)会产生大量无色无味的气泡,则步骤5反应的化学方程式为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
丙酸的结构为CH3—CH2—COOH,丙酸盐是安全有效的防霉、防腐剂,一种以碱式碳酸锌为原料的生产工艺流程如下: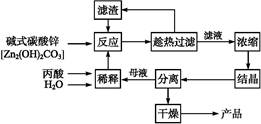
| 序号 | n(丙酸)∶ n(碱式碳酸锌) | 反应温度/℃ | 丙酸锌产率/% |
| 1 | 1∶0.25 | 60 | 67.2 |
| 2 | 1∶0.25 | 80 | 83.5 |
| 3 | 1∶0.25 | 100 | 81.4 |
| 4 | 1∶0.31 | 60 | 89.2 |
| 5 | 1∶0.31 | 80 | 90.1 |
| 6 | 1∶0.31 | 100 | 88.8 |
 ,反应温度 ℃。
,反应温度 ℃。 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com