
【题目】常温下,用0.1mol/LNaOH溶液分别滴定20mL浓度均为0.10mol/L的CH3COOH溶液和HCN溶液,所得滴定曲线如图所示。已知:CH3COOH的Ka=1.75×10-5,HCN的Ka=4.9×10-10。下列说法正确的是( )
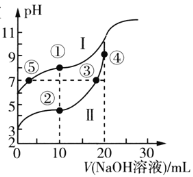
A.点①与点②对应的溶液中:c(CH3COO-)>c(CN-)
B.点②对应的溶液中:c(Na+)+c(H+)=c(CN-)+C(OH-)
C.点③和点⑤对应的溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
D.点④对应的溶液中:c(OH-)=c(H+)+c(CH3CO0H)
【答案】AD
【解析】
常温下用0.10mol/LNaOH溶液分别滴定20.00mL浓度均为0.10mol/LCH3COOH(Ka=1.75×10-5)溶液和HCN(Ka=4.9×10-10),对于同浓度同体积的CH3COOH和HCN来说,根据电离平衡常数可判断酸性CH3COOH>HCN,则起始时HCN的起点高于CH3COOH的起点,即I为HCN溶液中滴定NaOH溶液的曲线,II为CH3COOH溶液中滴定NaOH溶液的曲线;当滴加NaOH溶液的体积为10mL时,此时两种溶液中起始时分别恰好生成c(HCN):c(NaCN)=1:1,c(CH3COOH):c(CH3COONa)=1:1,当滴加NaOH的体积是20mL时,此时为化学计量点,溶液中分别恰好生成CH3COONa和NaCN,结合图象和溶液中的守恒思想,据此判断分析。
常温下用0.10mol/LNaOH溶液分别滴定20.00mL浓度均为0.10mol/LCH3COOH(Ka=1.75×10-5)溶液和HCN(Ka=4.9×10-10),对于同浓度同体积的CH3COOH和HCN来说,根据电离平衡常数可判断酸性CH3COOH>HCN,起始时HCN的起点高于CH3COOH的起点,即I为HCN溶液中滴定NaOH溶液的曲线,II为CH3COOH溶液中滴定NaOH溶液的曲线;当滴加NaOH溶液的体积为10mL时,此时两种溶液中起始时分别恰好生成c(HCN):c(NaCN)=1:1,c(CH3COOH):c(CH3COONa)=1:1,当滴加NaOH的体积是20mL时,此时为化学计量点,溶液中分别恰好生成CH3COONa和NaCN;
A.点①和点②所示溶液中,所加NaOH溶液的体积均为10.00mL,I溶液的组分为NaCN和HCN的起始量为1:1,II溶液的组分为CH3COONa和CH3COOH的起始量为1:1,此时I中HCN的电离对CN-的水解抑制能力比II中CH3COOH的电离对CH3COO-的抑制能力弱,则c(CH3COO-)>c(CN-),故A正确;
B.点②所示溶液中,所加NaOH溶液的体积为10.00mL,此时溶液的组分为CH3COONa和CH3COOH的起始量为1:1,不存在NaCN和HCN,故B错误;
C.点③和点⑤表示的溶液中,溶液均为中性,则溶液中c(H+)=c(OH-),对于I,溶液中存在HCN和NaCN,对于II,溶液中存在CH3COONa和CH3COOH,因起始时HCN和CH3COOH的总物质的量相等,则此时溶液中n(HCN) +n(CN-)=n(CH3COO-)+n(CH3COOH),因加入NaOH溶液体积不等,则c(HCN) +c(CN-)≠c(CH3COO-)+c(CH3COOH),即c(CH3COO-)-c(CN-)≠c(HCN)-c(CH3COOH),故C错误;
D.点④溶液中溶质为醋酸钠,此时溶液中存在的电荷守恒式为c(CH3COO-)+c(OH-)=c(H+)+ c(Na+),物料守恒式为c(Na+)= c(CH3COO-)+ c(CH3COOH),将物料守恒代入电荷守恒得c(OH-)=c(H+)+c(CH3COOH),故D正确;
故答案为AD。


科目:高中化学 来源: 题型:
【题目】下列根据反应原理设计的应用,不正确的是
A. CO32-+H2O![]() HCO3-+OH-:用热的纯碱溶液清洗油污
HCO3-+OH-:用热的纯碱溶液清洗油污
B. A13++3H2O![]() Al(OH)3(胶体)+3H+:明矾净水
Al(OH)3(胶体)+3H+:明矾净水
C. TiCl4+(x+2)H2O(过量)![]() TiO2·xH2O↓+4HCl:制备TiO2纳米粉
TiO2·xH2O↓+4HCl:制备TiO2纳米粉
D. SnCl2+H2O![]() Sn( OH)Cl↓+HCl配制氯化亚锡溶液时加入氢氧化钠溶液
Sn( OH)Cl↓+HCl配制氯化亚锡溶液时加入氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用活性炭还原处理氮氧化物,有关反应为C(s)+2NO(g) ![]() N2(g)+CO2(g)。
N2(g)+CO2(g)。
(1)写出上述反应的平衡常数表达式_______________。
(2)在2L恒容密闭器中加入足量C与NO发生反应,所得数据如表,回答下列问题。
实验编号 | 温度/℃ | 起始时NO的物质的量/mol | 平衡时N2的物质的量/mol |
1 | 700 | 0.40 | 0.09 |
2 | 800 | 0.24 | 0.08 |
①结合表中数据,判断该反应的△H____0(填“>”或“<”),理由是_________。
②判断该反应达到平衡的依据是_______。
A.容器内气体密度恒定 B.容器内各气体浓度恒定
C.容器内压强恒定 D.2v正(NO)= v逆(N2)
(3)700℃时,若向2L体积恒定的密闭容器中充入一定量N2和CO2发生反应:N2(g)+CO2(g)![]() C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。

①0~10 min内的CO2平均反应速率v=____________。
②图中A点v(正)___v(逆)(填“>”、“<”或“=”)。
③第10 min时,外界改变的条件可能是_____________。
A.加催化剂 B.增大C的物质的量
C.减小CO2的物质的量 D.升温 E.降温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各装置能够达到相应实验目的是
A.用装置甲验证苯中是否有独立的碳碳双键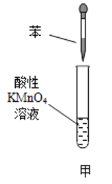
B.用装置乙证明![]() 酸性强于苯酚
酸性强于苯酚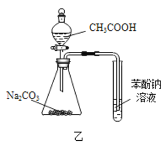
C.用装置丙制取乙烯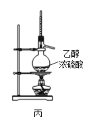
D.用装置丁除去乙酸乙酯中混有的少量乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.100 0 mol·L-1NaOH溶液滴定20.00 mL 0.100 0mol·L-1CH3COOH溶液所得滴定曲线如下图。下列说法正确的是

A. 点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B. 溶液中②、③点水的电离程度:③>②
C. 点②所示溶液中:c(Na+)=c(CH3COO-)=c(H+)=c(OH-)
D. 该滴定过程应该选择甲基橙作为指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶液平衡均属于化学平衡。
(1)已知H2A在水中存在以下平衡:H2A=H++HA-,HA-![]() H++A2-。
H++A2-。
①NaHA溶液的pH___填大于、小于或等于)Na2A溶液的pH。
②某温度下,若向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/LKOH溶液至溶液呈中性。此时该混合溶液中下列关系中,一定正确的是___。
A.c(H+)·c(OH-)=1×10-14 B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+) D.c(Na+)+c(K+)=0.05mol/L
③已知常温下H2A的钙盐(CaA)的饱和溶液中存在平衡:CaA(s)![]() Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有__。
Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有__。
A.升高温度 B.降低温度 C.加入NH4Cl晶体 D.加入Na2A固体
④(CaA)的饱和溶液中存在平衡:CaA(s)![]() Ca2+(aq)+A2-(aq) ΔH>0,加入Na2A固体,Ksp会___(填“变大”或“变小”或“不变”)
Ca2+(aq)+A2-(aq) ΔH>0,加入Na2A固体,Ksp会___(填“变大”或“变小”或“不变”)
(2)常温下,若在0.10mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=___mol·L-1(Ksp[Cu(OH)2]=2.2×10-20)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述与图象对应符合的是( )

A. 对于达到平衡状态的N2(g)+3H2(g)![]() 2NH3(g)在t0时刻充入了一定的NH3,平衡逆向移动
2NH3(g)在t0时刻充入了一定的NH3,平衡逆向移动
B. P2>P1,T1>T2
C. 该图象表示的方程式为:2A===B+3C
D. 对于反应2X(g)+3Y(g)![]() 2Z(g) ΔH<0,y可以表示Y的百分含量
2Z(g) ΔH<0,y可以表示Y的百分含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表。
实验方案 | 实验现象 |
①用砂纸擦后的镁带与沸水反应,再向反应液中滴加酚酞 | A.浮于水面,熔成小球,在水面上无定向移动,随之消失,溶液变成红色 |
②向新制的H2S饱和溶液中滴加新制的氯水 | B.产生大量气体,可在空气中燃烧,溶液变成浅红色 |
③钠与滴有酚酞试液的冷水反应 | C.反应不十分强烈,产生的气体可以在空气中燃烧 |
④镁带与2mol·L-1的盐酸反应 | D.剧烈反应,产生的气体可以在空气中燃烧 |
⑤铝条与2mol·L-1的盐酸反应 | E.生成白色胶状沉淀,继而沉淀消失 |
⑥向氯化铝溶液中滴加氢氧化钠溶液 | F.生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:______________________________________。
(2)实验用品:仪器___________________等;药品________________________等。
(3)实验内容:(*填写题给信息表中的序号)
实验方案* | 实验现象* | 有关化学方程式 |
_______________________________
(4)实验结论:______________________________________。
(5)请从结构理论上简单说明具有上述结论的原因___________________。
(6)请你补充一组实验方案(简单易行),证明此周期中另外两种元素的性质递变规律_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了有效实现NO和NO2的相互转化,设计如下实验:按图组装好实验装置,并检验装置气密性,实验前用排水法收集半瓶NO气体。

(1)打开止水夹,推动针筒活塞,使O2进入烧瓶。关闭止水夹,首先观察到烧瓶中的现象:__,产生此现象的化学方程式为__。
(2)轻轻摇动烧瓶,观察到烧瓶中的现象为:__,产生此现象的化学方程式为__。
(3)欲使烧瓶中尽可能全充满液体,操作的关键是__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com