
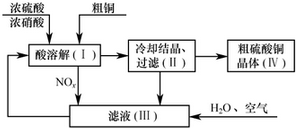
分析 浓硝酸具有强氧化性,在硫酸存在下,可与铜反应生成硫酸铜、氮氧化物和水,冷却结晶、过滤可得到硫酸铜晶体,滤液中含有硫酸、硝酸,氮氧化物、氧气通入滤液中生成硝酸,可循环使用.
(4)NO2中N元素的化合价为+4价,反应后升高到+5价,氧气从0价变为-2价,根据化合价升降相等配平该反应方程式;
(5)反应中氮原子完全转化成二氧化氮,硫酸提供氢离子,据此写出总反应的化学方程式;
(6)根据制备流程判断可以循环利用的物质.
解答 解:浓硝酸具有强氧化性,在硫酸存在下,可与铜反应生成硫酸铜、氮氧化物和水,冷却结晶、过滤可得到硫酸铜晶体,滤液中含有硫酸、硝酸,氮氧化物、氧气通入滤液中生成硝酸,可循环使用.
(4)NO2中N元素的化合价为+4价,反应后升高到+5价,化合价变化为:5-4=1,氧气从0价变为-2价,化合价变化为4价,则化合价变化的最小公倍数为4,则氧气的系数为1,NO2的系数为4,然后根据观察法配平可得:4NO2+2H2O+O2=4HNO3,
故答案为:4;2;1;4;
(5)Cu与HNO3(浓)反应,只有2molHNO3被还原,另2molH+由H2SO4提供,总反应的化学方程式为:Cu+2HNO3+H2SO4=CuSO4+2NO2↑+2H2O,
故答案为:Cu+2HNO3+H2SO4=CuSO4+2NO2↑+2H2O;
(6)根据制备流程可知,可以循环利用的为HNO3(或NO2),
故答案为:HNO3(或NO2).
点评 本题考查了浓硫酸的化学性质、硫酸铜的制备等知识,题目难度中等,注意掌握浓硫酸的化学性质,能够根据化合价变化配平氧化还原反应,试题培养了学生灵活应用基础知识的能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
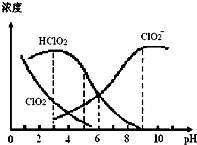 亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.某温度下,部分含氯组分含量随pH变化情况如图所示,下列说法不正确的是( )
亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.某温度下,部分含氯组分含量随pH变化情况如图所示,下列说法不正确的是( )| A. | 使用该漂白剂的适宜pH约为5.0 | |
| B. | 该温度下NaClO2溶液中:c( Na+)>c(ClO2-)>c(OH-)>c(H+) | |
| C. | 不同pH的NaClO2溶液中存在下列关系:c ( Na+)=c(ClO2-)+c(HClO2)+c(ClO2) | |
| D. | 该温度下HClO2的电离平衡常数的数值:Ka≈1.0×10-6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2能使溴水褪色,体现其漂白性 | |
| B. | NOx、CO2、PM 2.5颗粒都会导致酸雨 | |
| C. | 钠钾合金可用于快中子反应堆的热交换剂 | |
| D. | 等质量的NaHCO3按a、b两种途径完全转化,途径a比途径b消耗更多的盐酸 途径a:NaHCO3 $\stackrel{△}{→}$Na2CO3 $\stackrel{盐酸}{→}$CO2;途径b:NaHCO3$\stackrel{盐酸}{→}$CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高纯硅可用于制作光导纤维 | B. | 光化学烟雾的形成与氮氧化物有关 | ||
| C. | 氧化铝可用于制作高温耐火材料 | D. | 明矾可用作净水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 实验结论 |
| A | 将SO2通入Ba(NO3)2溶液中,溶液变浑浊 | 生成BaSO3沉淀 |
| B | 点燃CO还原Fe2O3后的尾气,气体未能燃烧 | CO已完全反应 |
| C | 向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中加入几滴新制氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| D | 向鸡蛋清溶液中加入少量CuSO4溶液,出现浑浊 | 蛋白质发生了盐析 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的裂化、煤的液化、蛋白质的盐析、焰色反应都是化学变化 | |
| B. | 在元素周期表的金属和非金属分界线附近可寻找锗、硅、硒等半导体材料 | |
| C. | 铅蓄电池是常见的二次电池.性能优良.比能量高.缺点是废弃电池污染严重 | |
| D. | 在新型催化剂条件下通过电力可将二氧化碳氧化为甲醇、甲烷等燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
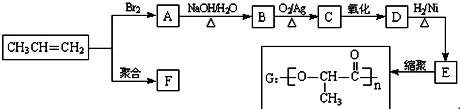
 +2H2O.
+2H2O. .
.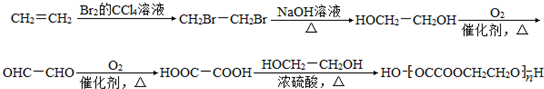 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com