
请回答下列实验室中制取气体的有关问题。
(1)如图是用KMnO4与浓盐酸反应制取适量氯气的简易装置。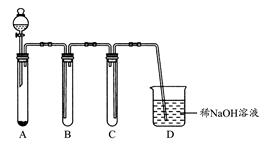
装置B,C,D的作用分别是:B ;C ;D 。
(2)在实验室欲制取适量NO气体。
①下图中最适合完成该实验的简易装置是 (填序号);
②根据所选的装置完成下表;(不需要的可不填)
| | 应加入的物质 | 所起的作用 |
| A | | |
| B | | |
| C | | |
| D | | |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
为了验证木炭可被浓H2SO4氧化成CO2,选用下图所示仪器(内含物质)组装成实验装置: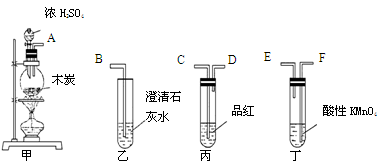
(1)如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):
接 , 接 , 接 ;
(2)仪器乙、丙应有怎样的实验现象才表明已检验出CO2?
乙中 ____ ,丙中 ______ ;
(3)丁中酸性KMnO4溶液的作用是 ;
(4)写出甲中反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产ClO2的工艺主要包括:①粗盐精制;②电解微酸性NaCl溶液;③ClO2的制取。工艺流程如下图: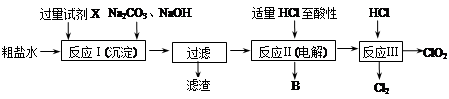
⑴ 粗食盐水中含有Ca2+、Mg2+、SO42-等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,X是 (填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO42-,其原因是 。(已知:Ksp(BaSO4)=1.1×10-10;Ksp(BaCO3)=5.1×10-9)
⑵上述过程中,将食盐水在特定条件下电解得到的氯酸钠与盐酸反应生成ClO2。电解时生成的气体B是 ;反应Ⅲ的化学方程式为 。
⑶ ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知:I2+2S2O32-=2I-+S4O62-)
① 准确量取10.00 mL ClO2溶液的玻璃仪器是 。
② 滴定过程中,至少须平行测定两次的原因是 。
③ 根据上述步骤可计算出原ClO2溶液的物质的量浓度为 mol·L-1(用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料——光导纤维,C与烧碱反应生成含A元素的化合物D。
(1)在元素周期表中,A位于 族,与A同族但相对原子质量比A小的元素B的原子结构示意图为 ,A与B在原子的电子层结构上的相同点是 。
(2)易与C发生化学反应的酸是 ,反应的化学方程式是 。
(3)将C与纯碱混合高温熔融时也发生化学反应生成D,同时还生成B的最高价氧化物E;将全部的E与全部的D在足量的水中混合后,又发生化学反应生成含A的化合物F。
①写出生成D和F的化学反应方程式: 。
②要将纯碱高温熔化,下列坩埚中可选用的是 。
A.普通玻璃坩埚 B.石英玻璃坩埚
C.氧化铝坩锅 D.铁坩锅
(4)100 g C与石灰石的混合物充分反应后,生成的气体在标准状况下的体积为11.2 L,100 g混合物中石灰石的质量分数是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硅单质及其化合物应用很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下: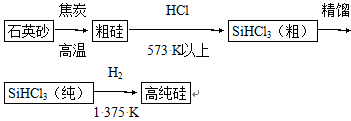
①写出由纯SiHCl3制备高纯硅的化学反应方程式____________________。
②整个制备过程必须严格控制无水、无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式____________________;H2还原SiHCl3过程中若混有O2,可能引起的后果是____________________。
(2)下列有关硅材料的说法正确的是 ( )。
A.单质硅化学性质稳定,但可以被强碱溶液腐蚀
B.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
C.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
D.光导纤维的主要成分是SiO2
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入盐酸,振荡。写出实验现象并给予解释(用化学方程式说明)_________________________ ____。
(4)在人体器官受到损伤时,需要使用一种新型无机非金属材料来植入体内,这种材料是________(填字母)。
A.高温结构陶瓷 B.生物陶瓷 C.导电陶瓷
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图中A~J分别代表相关反应的一种物质。已知A分解得到等物质的量的B、C、D,图中有部分生成物未标出。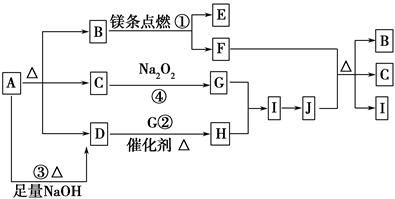
已知:2Mg+CO2 2MgO+C,请填写以下空白:
2MgO+C,请填写以下空白:
(1)A的化学式________。
(2)写出反应②的化学方程式:________________________________________。
(3)写出反应③的离子方程式:________________________________________。
(4)J与F反应的化学方程式:_________________________________________。
(5)在反应④中,当生成标准状况下2.24 L G时,转移电子数为________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
为了防治酸雨,减少煤燃烧时向大气排放的SO2,工业上采用生石灰和含硫的煤混合使用以“固硫”(避免硫的化合物进入大气),最后生成石膏。试回答:
(1)整个“固硫”反应所涉及的反应类型包括:①化合反应②分解反应 ③置换反应 ④复分解反应 ⑤氧化还原反应 ⑥非氧化还原反应 ⑦离子反应 ⑧非离子反应(分子反应)。其中正确的是( )。
A.①⑤⑥⑦ B.①②③⑤⑧ C.①⑤⑥⑧ D.②④⑤⑦
(2)第一步“固硫”反应的化学方程式中所需气态物质的化学计量数为( )
A.1 B.2 C.3 D.4
(3)比较此法与石灰石粉末与含硫煤混合法哪个更好些________(A.生石灰 B.石灰石),原因是________。
(4)你认为减少酸雨产生可采取的措施是( )。
①少用煤作燃料 ②把工厂的烟囱造高 ③先将燃料煤脱硫 ④在土壤中加石灰防止酸化 ⑤开发新能源,避免含S、N的氧化物大量排放
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图①—⑩分别代表有关反应中的一种物质,其中③气体能使酚酞试液变红,⑦是红综色气体,回答: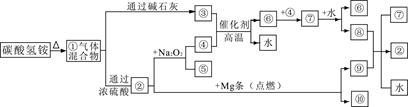
(1)①中的混合气体通过浓硫酸发生化学反应,主要生成物的化学式是 。
(2)写出碳酸氢铵中阳离子的检验方法 。
(3)写出工业上合成③的化学方程式 。
(4)⑧与⑨反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在半导体工业中有这样一句话:“从沙滩到用户”,其中由粗硅制纯硅的常用方法为:Si(粗)+2Cl2=SiCl4 SiCl4+2H2=Si(纯)+4HCl。若在25℃101KPa条件下反应生成HCl气体49L(注:25℃101KPa条件下气体摩尔体积为24.5L/mol)则:
(1)反应生成HCl气体的质量为__________,转移电子的个数为_____________。
(2)反应生成的HCl气体溶于127mL水中,得到密度为1.20g/mL的盐酸,此盐酸的物质的量浓度为 。
(3)“从沙滩到用户”涉及到多个反应,其中制取粗硅的反应方程式为 ,纯净的石英砂与烧碱反应可以制得水玻璃,反应的离子方程式为 。
(4)普通玻璃若以氧化物形式表示其组成为(质量分数):Na2O 13%,CaO 11.7%,SiO2 75.3%。现以石灰石、纯碱和石英为原料生产这种玻璃10t,石灰石的利用率为80%,纯碱和石英的利用率为95%,至少需要上述原料的质量是 t(保留两位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com