
| 序号 | ① | ② | ③ | ④ |
| 溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
| pH | 7.0 | 7.0 | 8.1 | 8.4 |
| A. | 酸性强弱:H2CO3>HF | |
| B. | ①和②中溶质均未水解 | |
| C. | 离子的总浓度:①>③ | |
| D. | ④中:c(HCO3-)+2c(CO32-)+c(H2CO3)═0.1 mol/L |
分析 A、NaF和NaHCO3溶液中阴离子水解显碱性,对应酸性越弱,阴离子水解程度越强;
B、氯化钠溶液是强酸强碱溶液不水解,醋酸铵溶液是弱酸弱碱盐,醋酸根离子和铵根离子水解程度相同,溶液显中性;
C、氯化钠溶液是强酸强碱溶液不水解,溶液中氢离子浓度等于氢氧根离子浓度,NaF溶液中氟离子水解破坏了水的电离,溶液中氢氧根离子浓度大于氢离子浓度,结合溶液中电荷守恒比较大小;
D、依据碳酸氢钠溶液中存在物料守恒,碳元素物质的量总量不变.
解答 解:A、NaF和NaHCO3溶液中阴离子水解显碱性,对应酸性越弱,阴离子水解程度越强,碳酸氢钠溶液pH大于NaF溶液PH,则对应酸性为H2CO3<HF,故A错误;
B、氯化钠溶液是强酸强碱溶液,溶液pH=7,溶液不水解,醋酸铵溶液是弱酸弱碱盐,溶液pH=7,说明醋酸根离子和铵根离子水解程度相同,溶液显中性,①和溶质未水解,②中溶质发生双水解,故B错误;
C、氯化钠溶液是强酸强碱溶液不水解,溶液中氢离子浓度等于氢氧根离子浓度,NaF溶液中氟离子水解破坏了水的电离,溶液中氢氧根离子浓度大于氢离子浓度,溶液中电荷守恒c(Na+)+c(H+)=c(OH-)+c(Cl-),溶液呈中性得到c(Na+)=c(Cl-),c(Na+)+c(H+)=c(OH-)+c(F-),溶液呈碱性,c(H+)<c(OH-),得到c(Na+)>c(F-),离子的总浓度:①>③,故C正确;
D、依据碳酸氢钠溶液中存在物料守恒,碳元素物质的量总量不变,④中物料守恒:c(HCO3-)+c(CO32-)+c(H2CO3)=0.1mol/L,故D错误,
故选C.
点评 本题考查了电解质溶液中离子浓度大小、电荷守恒分析判断,物料守恒的理解应用,注意盐类水解的分析应用,掌握基础是关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
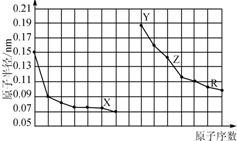
| A. | 异戊二烯(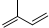 )与等物质的量的Br2发生加成反应 )与等物质的量的Br2发生加成反应 | |
| B. | 2-氯丁烷(CH3CHClCH2CH3)与NaOH乙醇溶液共热 | |
| C. | 甲苯在一定条件下发生硝化生成一硝基甲苯的反应 | |
| D. | 甲醇在铜催化和加热条件下生成的产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溴乙烷与氢氧化钠水溶液共热 | |
| B. | 溴乙烷与氧氧化钠的乙醇溶液共热 | |
| C. | 甲烷与氯气反应 | |
| D. | 乙炔与氯化氢在一定条件下制氯乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、R的最高化合价相同 | |
| B. | 简单离子的半径:X>Y>Z | |
| C. | Y、Z、R对应的最高价氧化物的水化物相互之间可以发生反应 | |
| D. | 电解熔融的X与Z构成的化合物可以得到单质Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液颜色保持不变,说明上述可逆反应达到平衡状态 | |
| B. | 若用绿矾(FeS04•7H2O)作还原剂,处理1 L废水,至少需要458.7g | |
| C. | 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5 | |
| D. | 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
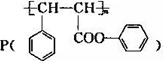 是一种环保型的新涂料,其合成路线如下图所示:
是一种环保型的新涂料,其合成路线如下图所示: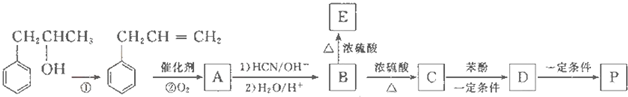
 .
. .
. .
. (写出其中一种的结构简式).
(写出其中一种的结构简式).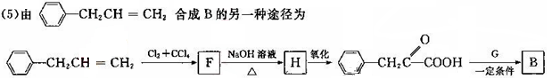
 ,试剂G的化学式H2.
,试剂G的化学式H2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量NaNO3固体,v(H2)减小 | B. | 20mL BaCl2溶液,v(H2)不变 | ||
| C. | 少量NaHSO4固体,v(H2)不变 | D. | 改用18mol/L的硫酸,v(H2)增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com