
【题目】已知X(g)+ 3Y(g) = 2Z(g) ΔH>0,下列对该反应的说法中正确的是( )
A.ΔS>0B.能自发进行
C.反应物总能量大于生成物总能量D.在任何温度下都不能自发进行
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】水溶性离子是大气颗粒物的主要成分,研究其化学组成对于治理大气污染其有重大意义,某地区大气颗粒物经采样与必要的预处理后得试样溶液。经离子色谱检验确定含有以下离子NH4+、Na+、Mg2+、Ca2+、Al3+、SO42-、NO3-、CO32-、Cl-。某同学对其再进行如下的实验:

已知:在加热与强碱性条件下,铝单质可以将NO3-还原为氨气。
回答下列问题:
(1)“气体1“的电子式为_________。
(2)生成“沉淀1”的离子方程式为________。
(3)“沉定2”的成分是___________(填化学式)。
(4)“溶液3![]() 气体2”的离子方程式为_________。
气体2”的离子方程式为_________。
(5)根据上述实验可推断该地区大气颗粒物中__________含量较低(填离子符号)。
(6)已知大气颗粒物中各元素的行染主体如下表:
元素 | N | S | Na、Mg、Cl | Al | Ca |
污染主体 | 机动车尾气 | 燃煤污染 | 海盐离子 | 土壤扬尘 | 建筑粉尘 |
根据实验结果可判断该地区大气颗粒物污染主体有___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验或实验操作和现象,所得结论正确的是
实验或实验操作 | 现象 | 实验结论 | |
A | 用大理石和盐酸反应制取CO2气体,立即通入一定浓度的Na2SiO3溶液中 | 出现白色沉淀 | H2CO3的酸性比H2SiO3的酸性强 |
B | 向某溶液先滴加硝酸酸化,再滴加BaCl2溶液 | 出现白色沉淀 | 原溶液中含有SO42-、SO32-、HSO3-中的一种或几种 |
C | 将纯Zn片与纯Cu片用导线连接,浸入到稀硫酸溶液中 | Cu片表面产生大量气泡 | 金属性:Zn>Cu |
D |
| 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属氧化还原反应,又属放热反应的是 ( )
A.铝片与稀盐酸的反应B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的碳与二氧化碳的反应D.氢氧化钠和硫酸的中和反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化钙(Ca3N2)氮化钙是一种棕色粉末,在空气中氧化,遇水会发生水解,生成氢氧化钙并放出氨。某化学兴趣小组设计制备氮化钙并测定其纯度的实验如下:
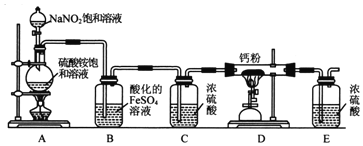
Ⅰ.氮化钙的制备
(1)连接装置后,检查整套装置气密性的方法是_____________________。
(2)装置A中每生成标准状况下4.48LN2,转移的电子数为___________________。
(3)装置B的作用是吸收氧气,则B中发生反应的离子方程式为__________。装置E的作用是______________________。
(4)实验步骤如下:检查装置气密性后,装入药品;_____________________(请按正确的顺序填入下列步骤的代号)。
①加热D处的酒精喷灯; ②打开分液漏斗活塞; ③加热A处的酒精灯;④停上加热A处的酒精灯;⑤停止加热D处的酒精喷灯
(5)请用化学方法确定氮化钙中含有未反应的钙,写出实验操作及现象___________。
Ⅱ.测定氮化钙的纯度:
①称取4.0g反应后的固体,加入足量水,将生成的气体全部蒸出并通入100.00mL1.00mol·L-1盐酸中,充分反应后,将所得溶液稀释至200.00mL;
②取20.00mL稀释后的溶液,用0.20mol·L-1NaOH标准溶液滴定过量的盐酸,达到滴定终点时,消耗标准溶液25.00mL。
(1)氮化钙的质量分数为_________。
(2)达到滴定终点时,仰视滴定管读数将使测定结果_________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是( )
A. 碘水中通入适量的SO2:I2+SO2+2H2O===2I-+SO42-+4H+
B. NH4HCO3溶液与足量NaOH溶液混合后加热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
C. NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-===BaCO3↓+2H2O+CO32-
D. 向Ca(ClO) 2溶液中通入SO2:Ca2++2ClO-+H2O+SO2===CaSO3↓+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组探究甲烷与氯气的取代反应,装置、现象如下:
现象 |
ⅰ.光照后,产生白雾,混合气体颜色变浅 ⅱ.试管内液面上升至试管的2/3;试管壁和液面上出现少量油状液滴 |

下列说法不正确的是
A. 饱和食盐水可以减少氯气的溶解
B. 油状液滴的主要成分是一氯甲烷
C. 产生白雾以及试管内液面上升证明有氯化氢生成
D. 为了探究反应条件,可用黑色纸套套住装满甲烷和氯气的试管,一段时间后进行观察
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,A与D同周期,A的单质既可与盐酸反应,又可与NaOH溶液反应,B的单质在放电条件下能与氧气反应,C元素的离子不含电子,D元素原子的最外层电子数是其次外层电子数的3/4,E元素原子的最外层电子数是其次外层电子数的3倍。
(1)A的离子结构示意图为_______________,E元素在周期表的位置是_____________________。
(2)用电子式表示C的氧化物的形成过程____________________________
(3)比较B、D、E的氢化物的沸点由高至低:_____________________________。
(4)化合物甲由元素A、B组成,具有良好电绝缘性。化合物甲能与水缓慢反应生成化合物乙。乙分子中含有10个电子,写出该反应的化学方程式:________________。 。
(5)化学家鲍林在研究含氧酸的强弱时,提出了一个定性规则:含氧酸分子中的非羟基(注:羟基是—OH)氧原子数与酸性强弱成相关性。设含氧酸化学式为HnROm,则非羟基氧原子数为(m-n),其数值越大,该含氧酸的酸性越强。鲍林认为含氧酸的强弱与非羟基氧原子数(m-n)有如下关系:
m-n | 0 | 1 | 2 | 3 |
含氧酸强度 | 弱 酸 | 中 强 | 强 | 很 强 |
实 例 | HClO | H3PO4 | HNO3 | HClO4 |
①规则判断H2CrO4、HMnO4酸性由强到弱的顺序为_________________。
②As为第ⅤA元素,H3AsO3为弱酸,H3PO3为中强酸,试推断H3AsO3的分子结构式为________,H3PO3为的结构式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列药品保存方法,正确的是 ( )
A. 乙醇密封保存,放置于阴凉处
B. 氢氧化钠溶液用橡胶塞密封保存在细口瓶中
C. 浓硫酸保存在广口瓶中,没有挥发性,无须密封
D. 金属钠和钾等很活泼的金属可以保存在煤油或石蜡中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com