
| A. | V1>V2 | B. | V1<V2 | C. | V1=V2 | D. | V1≤V2 |
科目:高中化学 来源: 题型:选择题
| A. | 水是一种弱电解质 | B. | NH4ClO4溶液显酸性 | ||
| C. | NaClO4中含有离子键和共价键 | D. | NH4ClO4只有氧化性,没有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 活化分子间的碰撞一定是有效碰撞 | |
| B. | 活化分子具有的能量是活化能 | |
| C. | 活化分子的总数越多,反应速率越快 | |
| D. | 单位时间内有效碰撞次数越多,反应速率越快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2在反应中既作氧化剂又作还原剂 | |
| B. | O2是氧化产物 | |
| C. | Na2FeO4既是氧化产物又是还原产物 | |
| D. | 2molFeSO4发生反应时,共有12mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.7 | B. | 3.0 | C. | 4.5 | D. | 3.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
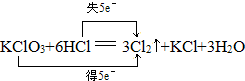 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N×10-2 mol/L | B. | $\frac{N}{1.204×1{0}^{22}}$ mol/L | ||
| C. | $\frac{N}{6.02×1{0}^{21}}$mol/L | D. | $\frac{N}{6.02×1{0}^{25}}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠溶液在电流作用下电离成钠离子和氯离子所以能导电 | |
| B. | 二氧化硫的水溶液能导电,所以二氧化硫是电解质 | |
| C. | 硫酸钡难溶于水,但硫酸钡属于电解质 | |
| D. | 液态氯化氢不导电,所以氯化氢是非电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com