
| A. | 1L水中溶解了58.5gNaCl,该溶液的物质的量浓度为1mol/L | |
| B. | 从1L 2mol/L的H2SO4溶液中取出0.5L,该溶液的浓度为1mol/L | |
| C. | 配制500mL 0.1mol/L的CuSO4溶液,需8.0g硫酸铜固体 | |
| D. | 0.1mol/L MgCl2溶液中Cl-浓度为0.1mol/L |
分析 A、1L水中溶解了58.5gNaCl,溶液体积不是1L;
B、溶液是均一稳定的分散系,浓度一定,和溶液体积无关;
C、依据n=CV计算溶质物质的量,结合元素守恒计算晶体硫酸铜质量分析;
D、0.1mol/L MgCl2溶液中Cl-浓度为0.2mol/L.
解答 解:A、1L水中溶解了58.5gNaCl,物质的量=$\frac{58.5g}{58.5g/mol}$=1mol,溶液体积不是1L,该溶液的物质的量浓度不是1mol/L,故A错误;
B、溶液是均一稳定的分散系,浓度一定,和溶液体积无关,从1L 2 mol/L的H2SO4溶液中取出0.5L,该溶液的浓度是2mol/L,故B错误;
C、依据n=CV计算溶质物质的量=0.5L×0.1mol/L=0.05mol,结合元素守恒计算需硫酸铜固体质量=0.05mol×160g/mol=8.0g,故C正确;
D、0.1mol/L MgCl2溶液中Cl-浓度为0.2mol/L,故D错误;
故选C.
点评 本题考查了物质的量浓度的分析应用,主要是溶质物质的量的计算,溶液是均一稳定的分散系,浓度一定,和溶液体积无关,掌握基础是关键,题目较简单.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与FeCl3溶液反应:Fe+Fe3+═2Fe2+ | |
| B. | Fe与盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | FeCl2溶液与Cl2反应:Fe2++Cl2═Fe3++2Cl- | |
| D. | Fe(OH)3与盐酸反应:Fe(OH)3+3H+═Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅与氧化钙(高温) | B. | 二氧化硅与氢氧化钠(常温) | ||
| C. | 二氧化硅与碳(高温) | D. | 二氧化硅与浓HNO3(常温) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 如图 1 所示,若铜中含有杂质银,可形成原电池,且铜作负极 | |
| B. | 如图 2 所示,当有 0.1 mol 电子转移时,有 0.1 mol Cu2O 生成 | |
| C. | 基于绿色化学理念设计的制取 Cu2O 的电解池如图 2 所示,铜电极发生还原反应 | |
| D. | 若图 3 所示的装置中发生 Cu+2Fe3+═Cu2++2Fe2+的反应,则 X 极是负极,Y 极的材料可 以是铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的化学式为AgS | B. | 每生成1mo1X转移2mo1电子 | ||
| C. | 反应的还原剂是H2S | D. | 银针验毒时,空气中氧气失去电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
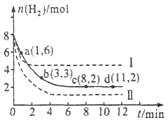 工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1
工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏法是海水淡化的方法之一 | |
| B. | 长期饮用纯净水,可能会引起一些微量元素的缺乏 | |
| C. | 含有细菌的水可以用臭氧杀菌 | |
| D. | 含有重金属离子的废水用可以用明矾处理 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com