
铅蓄电池的两极分别为Pb、PbO2,电解质溶液为H2SO4,电池放电时时的反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O,下列对电池放电时的分析正确的
A.Pb为正极被氧化 B.电子从PbO2 流向外电路
C.SO42-向PbO2处移动 D.电解质溶液pH不断增大
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案科目:高中化学 来源:2014-2015学年山东省新校高三4月模拟化学试卷(解析版) 题型:简答题
(15分)CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气。
(1)已知:CH4、H2和CO的燃烧热(△H)分别为-890.3kJ/mol、-285.8kJ/mol和-283.0kJ/mol,且1mol液态水汽化时的能量变化为44.0kJ。用1 m3(标准状况)的甲烷与水蒸气在高温下反应制取合成气所需的热量为 (保留整数)。
(2)在一定温度下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化如下表所示:
物质浓度 时间/min | 0 | 1 | 2 | 3 | 4 |
CH4 | 0.2mol·L-1 | 0.13 mol·L-1 | 0.1 mol·L-1 | 0.1 mol·L-1 | 0.09 mol·L-1 |
H2 | 0 mol·L-1 | 0.2 mol·L-1 | 0.3 mol·L-1 | 0.3 mol·L-1 | 0.33 mol·L-1 |
①计算该反应第一次达平衡时的平衡常数K 。
②3min时改变的反应条件是 (只填一种条件的改变即可)。
(3)已知温度、压强、投料比X[n(CH4)/n(H2O)]对该反应的影响如图所示。
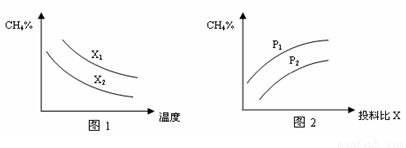
①图1中的两条曲线所示投料比的关系X1 X2(填“=”、“>”或“<”下同)。
②图2中两条曲线所示的压强比的关系:P1 P2。
(4)以天然气(设杂质不参与反应)、KOH溶液为原料可设计成燃料电池:
①放电时,负极的电极反应式为 。
②设装置中盛有100.0mL 3.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为8.96L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省台州市高一下学期第一次月考化学试卷(解析版) 题型:选择题
某烷烃发生氯代反应后,只能生成三种沸点不同的一氯代产物,此烷烃是
A.(CH3)2CHCH2CH2CH3 B.(CH3CH2)2CHCH3
C.(CH3)2CHCH(CH3)2 D.(CH3)3CCH2CH3
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省台州市高一下学期第一次月考化学试卷(解析版) 题型:选择题
某有机物在氧气中充分燃烧,生成等物质的量的水和二氧化碳,则该有机物必须满足的条件是
A.分子中的C、H、O的个数比为1:2:3
B.分子中C、H个数比为1:2
C.该有机物的相对分子质量为14
D.该分子中肯定不含氧元素
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省邛崃市高一下学期第一次月考化学试卷(解析版) 题型:填空题
(16分)I.(4分)已知拆开1mol H—H键,1mol N三N键分别需要吸收的能量为436kJ,946kJ;形成1mol N—H键,会放出能量391kJ,在反应N2 + 3H2== 2NH3中,每生成2mol NH3 ___ _热量(填:吸收或放出)_____ kJ。
II.(6分)我国经济发展对能源的需求与日俱增。一种新型燃料电池是将两根特制电极插入氢氧化钾溶液中,然后从两极分别通入甲烷和氧气,其电极反应式为:
X极:CH4+10OH- -8e- == CO32-+7H2O Y极:4H2O+2O2+8e- ==8OH-
(1)指出该电池的正极__________(X或Y)极
(2)在标准状况下,通入5.6L甲烷气体,完全反应后有__________mol电子转移;
(3)该电池的电解质溶液的PH变化是_______ ___(填升高、降低、不变)
III.(6分)利用Cu + 2FeCl3 = CuCl2 + 2FeCl2反应,设计一个原电池。
(1)画出装置图(在图中标出电极材料、正负极、电解质溶液)。
(2)写出电极反应方程式
负极: 正极:
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省邛崃市高一下学期第一次月考化学试卷(解析版) 题型:选择题
①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池。
①②相连时,外电路电流从②流向①;
①③相连时,③为正极;
②④相连时,②上有气泡逸出;
③④相连时,③的质量减少。
据此判断这四种金属活动性由大到小的顺序是
A.①③②④ B.①③④② C.③④②① D.③①②④
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省邛崃市高一下学期第一次月考化学试卷(解析版) 题型:选择题
表明金属甲比金属乙活动性强的叙述正确的是
A.在氧化还原反应中,甲失的电子比乙多
B.将甲和乙用导线相连接,一同放入CuSO4溶液中,乙的表面有红色的铜析出
C.同价态阳离子,甲比乙氧化性强
D.将甲、乙组成原电池时,甲为正极
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北武汉市高三毕业生四月调研测试理综化学试卷(解析版) 题型:选择题
25℃时,浓度均为0.1 mol/L的溶液,其pH如下表所示。有关说法正确的是
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
pH | 7.0 | 7.0 | 8.1 | 8.4 |
A.酸性强弱:H2CO3>HF
B.①和②中溶质均未水解
C.离子的总浓度:①>③
D.④中:c(HCO3-) + 2c(CO32-) + c(H2CO3)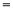 0.1 mol/L
0.1 mol/L
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南京市、盐城市高三第二次模拟考试化学试卷(解析版) 题型:实验题
B.【实验化学】
乙酰苯胺具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称。其制备原理如下:
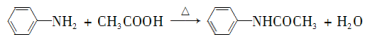
已知:
①苯胺易被氧化;
②乙酰苯胺、苯胺和醋酸的部分物理性质如下表:
物质 | 熔点 | 沸点 | 溶解度(20 ℃) |
乙酰苯胺 | 114.3 ℃ | 305 ℃ | 0.46 |
苯胺 | -6 ℃ | 184.4 | 3.4 |
醋酸 | 16.6 ℃ | 118 ℃ | 易溶 |
实验步骤如下:
步骤1:在50 mL圆底烧瓶中,加入5 mL苯胺、7.5 mL冰醋酸及少许锌粉,依照下图装置组装仪器。
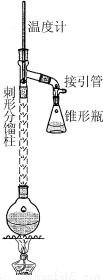
步骤2:控制温度计示数约105 ℃,小火加热回流1 h。
步骤3:趁热将反应混合物倒入盛有100 mL冷水的烧杯中,冷却后抽滤,洗涤,得到粗产品。
请回答下列问题:
(1)步骤1中加入锌粉的作用是____。
(2)步骤2中控制温度计示数约105 ℃的原因是____。
(3)步骤3中趁热将混合物倒入盛有冷水的烧杯中,“趁热”的原因是____。抽滤装置所包含的仪器除减压系统外还有________、________(填仪器名称)。
(4)步骤3得到的粗产品需进一步提纯,该提纯方法是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com