
����ѧ����ѡ��3���ʽṹ�����ʡ���15�֣�ԭ�������������������Ԫ��A��B��C��D�ֱ��ڵ�һ���������ڣ���Ȼ���д��ڶ���A�Ļ����Bԭ�Ӻ��������6�ֲ�ͬ���˶�״̬��B��C���γ����������η��ӣ�D�Ļ�̬ԭ�ӵ������ܲ�ֻ��һ�����ӣ������ܲ���ѳ������ӡ�
��ش��������⣺
��1��������Ԫ���е縺������Ԫ�أ����̬ԭ�ӵļ۵����Ų�ͼΪ ��
��2��C���������ǰ����Ԫ�طֱ���A�γɵĻ�����е��ɸߵ��͵�˳���� ���ѧʽ����������˵ݱ���ɵ�ԭ���� ��
��3��BԪ�ؿ��γɶ��ֵ��ʣ�һ�־���ṹ��ͼһ��ʾ����ԭ�ӵ��ӻ�����Ϊ ����һ�ֵľ�����ͼ����ʾ���þ����Ŀռ�������Ϊ ��������λ��Ч���֣����� ��
��

��4��DԪ���γɵĵ��ʣ��侧��Ķѻ�ģ��Ϊ ��D�Ĵ����ξ���ֲ��ṹ��ͼ�����þ����к��еĻ�ѧ���� (��ѡ�����)��
�ټ��Լ� �ڷǼ��Լ� ����λ�� �ܽ�����
��5����D����������Һ�еμӹ�����ˮ���۲쵽�������� ����д���������̵����ӷ���ʽ ��
��15�֣�
��1�� ��1�֣�
��1�֣�
��2��HF��HI��HBr��HCl ��1�֣�
HF����֮���γ������ʹ���е�ϸߣ�HCl��HBr��HI��������Խ���»���Խ�е�Խ�ߡ���2�֣�
��3��sp2 ��1�֣� 34% ��2�֣�
��4�������������ܶѻ� ��2�֣� �٢ڢ� ��2�֣�
��5����������ɫ��������1�֣� �����Ӱ�ˮ�������ܽ⣬�õ�����ɫ����Һ ��1�֣�
Cu2++2NH3��H2O��Cu(OH)2��+2NH4+ ;Cu(OH)2+4NH3�T�T [Cu(NH3)4]2++2OH-����1�֣���2�֣�
��������
������������������֪A��H;B��C��C��Cl��D��Cu����1��������Ԫ���е縺������Ԫ����Cl�����̬ԭ�ӵļ۵����Ų�ͼΪ ����2��C���������ǰ����Ԫ�طֱ���F��Cl��Br��I������H�γɵĻ������� HF��HCl��HBr��HI��ͬ��Ԫ���γɵ��⻯��ṹ���ƣ������ɷ��ӹ��ɵ����ʣ���Է�������Խ���Ӽ���������Խ�����ʵ��۷е��Խ�ߣ���HF����֮����˴�����һ��ķ��Ӽ��������⣬������������������˷���֮�����������ʹ���۷е��HI���ߡ����⼸���⻯��ķе��ɸߵ��͵�˳����HF��HI��HBr��HCl��������˵ݱ���ɵ�ԭ����HF����֮���γ������ʹ���е�ϸߣ�HCl��HBr��HI��������Խ���»���Խ�е�Խ�ߡ���3��BԪ�ؿ��γɶ��ֵ��ʣ�һ�־���ṹ��ͼһ��ʾ���þ�����ʯī���壬����ÿһ��̼ԭ���γ���2��̼̼������1��̼̼˫����������ԭ�ӵ��ӻ�����Ϊsp2�ӻ�����һ�������к��еĸ�Ԫ�ص�ԭ�Ӹ�����8��1+6��1/2+4=8,���辧���ı߳�ΪL,ԭ�ӵİ뾶Ϊr����þ����о����߳���ԭ�Ӱ뾶�Ĺ�ϵ��
����2��C���������ǰ����Ԫ�طֱ���F��Cl��Br��I������H�γɵĻ������� HF��HCl��HBr��HI��ͬ��Ԫ���γɵ��⻯��ṹ���ƣ������ɷ��ӹ��ɵ����ʣ���Է�������Խ���Ӽ���������Խ�����ʵ��۷е��Խ�ߣ���HF����֮����˴�����һ��ķ��Ӽ��������⣬������������������˷���֮�����������ʹ���۷е��HI���ߡ����⼸���⻯��ķе��ɸߵ��͵�˳����HF��HI��HBr��HCl��������˵ݱ���ɵ�ԭ����HF����֮���γ������ʹ���е�ϸߣ�HCl��HBr��HI��������Խ���»���Խ�е�Խ�ߡ���3��BԪ�ؿ��γɶ��ֵ��ʣ�һ�־���ṹ��ͼһ��ʾ���þ�����ʯī���壬����ÿһ��̼ԭ���γ���2��̼̼������1��̼̼˫����������ԭ�ӵ��ӻ�����Ϊsp2�ӻ�����һ�������к��еĸ�Ԫ�ص�ԭ�Ӹ�����8��1+6��1/2+4=8,���辧���ı߳�ΪL,ԭ�ӵİ뾶Ϊr����þ����о����߳���ԭ�Ӱ뾶�Ĺ�ϵ�� ����
���� �����Ըþ����Ŀռ�������Ϊ
�����Ըþ����Ŀռ�������Ϊ ����4��CuԪ���γɵĵ��ʣ��侧��Ķѻ�ģ��Ϊ�����������ܶѻ�������Cu�Ĵ����ξ���ֲ��ṹͼʾ��֪�þ����к��еĻ�ѧ���Ǽ��Լ����Ǽ��Լ�����λ�������ѡ���Ǣ٢ڢۡ���5����CuSO4��Һ�еμӹ�����ˮ�����ȷ�����ӦCu2++2NH3��H2O��Cu(OH)2��+2NH4+��������Һ������ɫ������������Ӧ: Cu(OH)2+4NH3�T�T [Cu(NH3)4]2++2OH-,�����ܽ⣬��Ϊ��ɫ��Һ��
����4��CuԪ���γɵĵ��ʣ��侧��Ķѻ�ģ��Ϊ�����������ܶѻ�������Cu�Ĵ����ξ���ֲ��ṹͼʾ��֪�þ����к��еĻ�ѧ���Ǽ��Լ����Ǽ��Լ�����λ�������ѡ���Ǣ٢ڢۡ���5����CuSO4��Һ�еμӹ�����ˮ�����ȷ�����ӦCu2++2NH3��H2O��Cu(OH)2��+2NH4+��������Һ������ɫ������������Ӧ: Cu(OH)2+4NH3�T�T [Cu(NH3)4]2++2OH-,�����ܽ⣬��Ϊ��ɫ��Һ��
���㣺����Ԫ�ص��ƶϡ�Ԫ��ԭ�ӵļ۵����Ų�ͼ�������۷е�ıȽϡ�ԭ�ӵ��ӻ�������Ŀռ乹�͡������ʵļ��㡢�������ڵĻ�ѧ�����͡���Ӧ��������ʽ����д��֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��ɽ��ʡ�����и�����ѧ����ĩ���Ի�ѧB�Ծ��������棩 ���ͣ�ѡ����
����ʵ�鲻�ܴﵽԤ��ʵ��Ŀ����
��� | ʵ������ | ʵ��Ŀ�� |
A | �����£���pH��ֽ�ⶨŨ��Ϊ0.1mol��L��1NaClO��Һ��0.1mol��L��1CH3COONa��Һ��pH | �Ƚ�HClO��CH3COOH������ǿ�� |
B | ��ʢ��1mL��������Һ���Թ��еμ�NaCl��Һ,�������г������ɣ��������еμ�Na2S��Һ | ˵��һ�ֳ�����ת��Ϊ��һ���ܽ�ȸ�С�ij��� |
C | ��������FeCl3��MgCl2��Һ�м�������Mg(OH)2��ĩ������һ����� | ��ȥMgCl2������FeCl3 |
D | �����£��ֱ���2֧�Թ��м�����ͬ�������ͬŨ�ȵ�Na2S2O3��Һ���ٷֱ������ͬ�����ͬŨ�ȵ�ϡ���� | �о�Ũ�ȶԷ�Ӧ���ʵ�Ӱ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�꽭��ʡ̩���н�����������ѧ���ڳ�������ѧ�Ծ��������棩 ���ͣ�ѡ����
һ�������½��з�Ӧ��A(g) B(g)+C (g)����2.0 L�����ܱ������г���1.0 mol A(g)������һ��ʱ���ﵽƽ�⡣��Ӧ�����в�õ��й����ݼ��±���
B(g)+C (g)����2.0 L�����ܱ������г���1.0 mol A(g)������һ��ʱ���ﵽƽ�⡣��Ӧ�����в�õ��й����ݼ��±���
t/s | 0 | 2 | 4 | 6 | 8 |
n(B)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
����˵����ȷ����
A����Ӧǰ2min��ƽ������v(B)=0.15 mol/��L��min��
B�����������������䣬�����¶ȣ�ƽ��ʱc(B)=0.22 mol��L-1,��Ӧ�Ħ�H < 0
C�����������������䣬��ʼ�������г���2.0 mol A����Ӧ�ﵽƽ��ʱC�����������С
D�����������������䣬��ʼ�������г���1.2 mol A��0.60 mol B��0.60 mol C����Ӧ�ﵽƽ��ǰ�����ʣ�v(��)<v(��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ����ʮУ������ѧ��3��ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
����ѧ��ѡ��2��ѧ�뼼����(15�֣�
�Ȼ���ͭ(CuCl)�ǰ�ɫ��ĩ������ˮ���������Ҵ����ڿ����лᱻѸ����������ɫ��ʽ�Ρ������Ե�Ʒ�Һ(��Ҫ��Cu2����Fe3��)���Ʊ��Ȼ���ͭ�Ĺ�������ͼ���£�
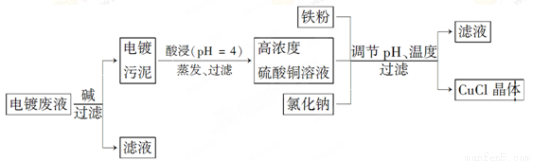
�������Ӻ�������ҺpH��CuCl��������ҺpH�Ĺ�ϵͼ��ͼ��

����֪����������Ũ��Ϊ1 mol��L��1ʱ��Fe(OH)3��ʼ�����ͳ�����ȫ��pH�ֱ�Ϊ1.4��3.0��Cu(OH)2��ʼ�����ͳ�����ȫ��pH�ֱ�Ϊ4.2��6.7��
��ش��������⣺
��1�����ʱ������Ӧ�����ӷ���ʽ��________������CuCl����ʱ�����pH��_______���ҡ�
��2�����ۡ��Ȼ��ơ�����ͭ����Һ�з�Ӧ����CuCl�����ӷ�Ӧ����ʽΪ________________��
��3��������CuCl����Ҫ��������ˮ�Ҵ�ϴ�ӣ�����ո��������70�����2 h����ȴ�ܷ��װ��70����ո���ܷ��װ��Ŀ����_____________________________________��
��4����Ʒ�˳�ʱ������Һ����Ҫ�ֳ���________���������Һ�л�ȡFeSO4��7H2O���壬����Ҫ֪������__________________��
��5���������ۻ�����������Ҳ�ɵõ��Ȼ���ͭ����д���÷�Ӧ�Ļ�ѧ����ʽ��____________________��Ϊ���CuCl�IJ��ʣ����ڸ÷�Ӧ��ϵ�м���ϡ����Һ������pH��3.5����������Ŀ����_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ����ʮУ������ѧ��3��ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����Ȼ�����һ��ʳ�����ϣ���ṹ��ʽ��ͼ��ʾ�����ڸ��л����������������ȷ����
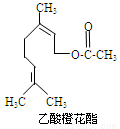
�ٷ���ʽΪC12H20O2
����ʹ����KMnO4��Һ��ɫ
���ܷ����ӳɷ�Ӧ�������ܷ���ȡ����Ӧ
������ͬ���칹���п����з����廯�������
�ڷ����廯�����ͬ���칹����8��
��1mol���л���ˮ��ʱֻ������1molNaOH
��1mol���л�����һ�������º�H2��Ӧ��������H2Ϊ3mol
A���٢ڢ� B���٢ڢ� C���٢ڢݢ� D���٢ڢܢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ��������DZ��������ѧ����ĩ�������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
ij�¶��£���2 L�����ܱ������г���1.0 mol A��1.0 mol B����ӦA(g)+B(g)  C(g)������һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±�������˵����ȷ����
C(g)������һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±�������˵����ȷ����
t/s | 0 | 5 | 15 | 25 | 35 |
m (A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A����Ӧ��ǰ5 s��ƽ������v(A)=0.17molL-1s-1
B�����������������䣬�����¶ȣ�ƽ��ʱc(A)=0.41molL-1����Ӧ�Ħ�H>0
C����ͬ�¶��£���ʼʱ�������г���2.0 mol C�ﵽƽ��ʱ��C��ת���ʴ���80��
D����ͬ�¶��£���ʼʱ�������г���0.20 mol A��0.20 mol B��1.0 mol C����Ӧ�ﵽƽ��ǰV(��)<V(��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ���и����꼶�����������ۻ�ѧ�Ծ��������棩 ���ͣ������
����ѧ����ѡ��3�����ʽṹ�����ʡ���15�֣�
A��B��C��D��E��Ԫ�����ڱ������ֶ�����Ԫ�أ�ԭ��������������A��B��C��Dλ��ͬһ���ڡ���֪Aԭ�Ӻ�����3���ܼ�����ÿ���ܼ��ϵ����ɵĵ�����Ŀ��ͬ��C��Eͬ���壬��C�ĵ���Ϊ�����е���Ҫ�ɷݡ�XԪ�ص�ԭ�Ӻ�����26���˶�״̬��ȫ����ͬ�ĵ��ӡ��ش��������⣺
��1��C��D��E�е�һ������������ ����Ԫ�ط��ţ���X�ļ۵����Ų�ʽΪ ��
��2��B����̬�⻯����ӳ� �Ρ��÷��ӵ�����ԭ�ӵ��ӻ���ʽΪ ��
��3��A��һ�ֵ�����Է�������Ϊ720�����ӹ���Ϊһ��32����,������12����Ԫ����20����Ԫ������ͼ1������1molA�����ֵ����Цм�����ĿΪ ��

��4��XԪ�ض�Ӧ�ĵ������γɾ���ʱ��������ͼ2��ʾ�Ķѻ���ʽ��

�����ֶѻ�ģ�͵���λ��Ϊ �����X��ԭ�Ӱ뾶Ϊa cm�������ӵ³�����ֵΪNA�������˵��ʵ��ܶȱ���ʽΪ g/cm3�����ػ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�㶫ʡ�����и�һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ������
��8�֣�
��1���ؿ��к�����ߵĽ����� ��NaHCO3�׳� ����������оƬ�İ뵼������� ��ˮ����������Ҫ�ɷ��� ��
��2���ڷ�Ӧ 3Cu+8 HNO3(ϡ)== 3Cu(NO3)2+2NO��+4H2O�У�ʧȥ���ӵ���_____����Ԫ�ط��ţ�������ԭ����_____����Ԫ�ط��ţ��������������4.48 L����ʱ���ĵ���ͭ_____g����ʱת����_____ mol���ӡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�㶫ʡ�����и�һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ӷ���ʽ��д��ȷ����
A��AlCl3��Һ�м��������ˮ Al3+��4NH3��H2O�� AlO2�� + 4NH4+ + 2H2O
B��Ba(OH)2��Һ�м���ϡ���� Ba2+ + OH�� + H+ + SO42-�� BaSO4��+ H2O
C��Cu(OH) 2��Һ�еμ����� Cu(OH) 2��2H+ �� Cu2+��2H2O
D��NaHCO3��Һ��������Һ�ķ�Ӧ HCO3����H+ �� H2O + CO2��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com