
【题目】【2017届广西省钦州市钦州港区高三12月月考】下列说法不正确的是( )
A.等物质的量浓度的 NH4HSO4溶液和NaOH溶液等体积混合,溶液中各离子浓度大小关系为:c(Na+)=c(SO42﹣)>c(NH4+)>c(H+)>c(OH﹣)
B.25℃ 时,将 a mo1L﹣l 氨水与 0.01 moIL﹣1 盐酸等体积混合,反应完全时溶液中c(NH4+)=c(C1﹣),用含a的代数式表示NH3H2O的电离常数Kb= ![]()
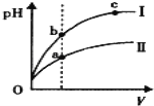
C.某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的 曲线如图所示。Ⅱ为醋酸稀释时pH的变化曲线,且a、b两点水的电离程度:a<b
D.已知298K时氢氰酸(HCN)的Ka=4.9×10﹣10、碳酸的Ka1=4.4×10﹣7,Ka2=4.7×10﹣11,据此可推测将氢氰酸加入到碳酸钠溶液中能观察到有气泡产生
【答案】D
【解析】
试题分析:A、向NH4HSO4溶液中加入等物质的量的NaOH溶液,反应生成Na2SO4、H2O、(NH4)2SO4;Na+、SO42-不水解,故c(Na+)=c(SO42-),NH4+水解显酸性,所以c(H+)>c(OH-),即离子浓度由大到小为:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-),故A正确;B、当溶液中c(NH4+)=c(C1-),说明溶液呈中性,有c(H+)=c(OH-)=10-7,故NH3H2O的电离平衡常数Kb= ![]() ,故B正确;C、醋酸为弱酸,存在电离平衡,当加水稀释时,氢离子浓度减小较慢,所以醋酸稀释时,pH增大较慢,曲线Ⅱ为醋酸的pH值变化,故C正确;D、酸性H2CO3>HCN>HCO3-,所以氢氰酸加入到碳酸钠溶液中,没有气体生成,故D错误;故选D。
,故B正确;C、醋酸为弱酸,存在电离平衡,当加水稀释时,氢离子浓度减小较慢,所以醋酸稀释时,pH增大较慢,曲线Ⅱ为醋酸的pH值变化,故C正确;D、酸性H2CO3>HCN>HCO3-,所以氢氰酸加入到碳酸钠溶液中,没有气体生成,故D错误;故选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的操作是 ( )
A.向水中通入二氧化碳气体 B.将水加热煮沸
C.向水中投入一小块金属钠 D.向水中加食盐晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.NaHS水解:HS﹣+H2O═S2﹣+H3O+
B.向氯化铁溶液中加入铁:Fe3++Fe═2Fe2+
C.氯化铝溶液加入过量的氨水:Al3++4NH3H2O═AlO2﹣+4NH4++2H2O
D.硫酸铜水解:Cu2++2H2O![]() Cu(OH)2+2H+
Cu(OH)2+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各图的叙述,正确的是

A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6Kj·mol-1
B.乙表示恒温恒容条件下发生的可逆反应2NO2![]() N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,HNO3既表现出氧化性,又表现出酸性的是
A.H2S+2HNO3=S↓+2NO2↑+2H2O
B.Cu +4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
C.CuO+2HNO3=Cu(NO3)2+H2O
D.4HNO3![]() 4NO2↑+O2↑+2H2O
4NO2↑+O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】区别NaCl、FeCl3和NH4Cl三种溶液,可选用下列试剂中的( )
A.KSCN溶液 B.NaOH溶液 C.AgNO3溶液 D.BaCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A是一种重要的化工原料,已知A是一种卤代烃,相对分子质量为92.5,其核磁共振氢谱中只有一个峰,C是一种高分子化合物,M是一种六元环状酯,转化关系如图所示,回答下列问题:
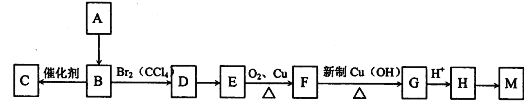
(1)A的分子式为_____;A→B的反应类型___;
(2)写出结构简式:D __,M的结构简式为___。
(3)写出下列反应的化学方程式:B→C:_____________;E→F_________________。
(4)满足下列条件的H的同分异构体共有__________种。写出其中一种同分异构体的结构简式______。
①属于酯类; ②能发生银镜反应; ③能与金属钠反应放出气体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com