
【题目】下列说法错误的是
A. 电解饱和食盐水可制取烧碱、氯气、氢气
B. 从海水中可提取镁、溴、碘等物质
C. 粗铜(含少量Zn、Fe、Pt等)电解精炼后,溶液中金属阳离子只有Fe2+、Zn2+
D. 在镀件上镀铜,镀件作阴极
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】实验室用乙醇和浓硫酸反应制备乙烯,化学方程式为:C2H5OH![]() CH2=CH2↑+H2O,接着再用液溴与乙烯反应制备1,2-二溴乙烷。在制备过程中由于部分乙醇与浓硫酸发生氧化还原反应还会产生CO2、SO2,并进而与Br2反应生成HBr等酸性气体。某学习小组用上述三种为原料,组装下列仪器(短接口或橡皮管均己略去)来制备1,2-二溴乙烷
CH2=CH2↑+H2O,接着再用液溴与乙烯反应制备1,2-二溴乙烷。在制备过程中由于部分乙醇与浓硫酸发生氧化还原反应还会产生CO2、SO2,并进而与Br2反应生成HBr等酸性气体。某学习小组用上述三种为原料,组装下列仪器(短接口或橡皮管均己略去)来制备1,2-二溴乙烷
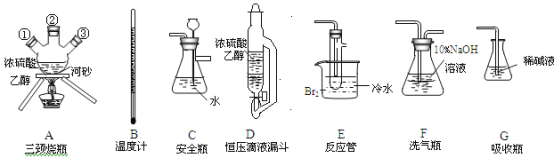
(1)如果气体流向从左到右,正确的连接顺序是:
B经A①插入A中,D接入②;A③接__接__接___接___。
(2)温度计水银球的正确位置是_________。
(3)装置D与分流漏斗相比,其主要优点是_______。
(4)装置C的主要作用是_______,装置F的作用是__________。
(5)在反应管E中进行的主要反应的化学方程式为________。
(6)装置E烧杯中的泠水和反应管内液溴上的水层作用均是_______________。若将装置F拆除,在E中的主要反应为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是( )
A. MnO2固体与浓盐酸反应制取Cl2:MnO2+4HCl![]() Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
B. AlCl3溶液中滴加浓氨水至过量:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
C. Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-=2Fe2++I2+3H2O
D. 向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O=HClO+HSO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 有机物的同系物具有相同的通式,且组成相差n(n>0的正整数)个CH2原子团,因此等质量的同系物完全燃烧时消耗氧气的物质的量相差1.5nmol
B. 根据卤代烃的消去反应一定能判断卤代烃中所含卤素原子的种类
C. 饱和一元醇可在一定条件下与氢卤酸发生取代反应
D. 分子式为C7H16的有机物中有三种不同化学环境的氢原子,此有机物一定是2,4―二甲基戊烷或3,3―二甲基戊烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】活性ZnO在橡胶、塑料、涂料工业有重要应用,工业上用含锌物料(含FeO、CuO等杂质)制取活性ZnO的流程如图所示:
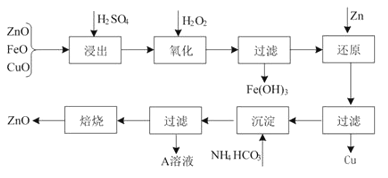
(1)上述流程中,浸出时用的是60% H2SO4(密度是1.5 g/cm3),则该H2SO4的物质的量浓度为______________ (保留两位小数) 。
(2)上述流程H2SO4浸出后溶液中Fe3+的浓度为0.04 mol·L-1,控制滤液的pH,加入H2O2后产生大量红褐色沉淀。
①粗略测定溶液pH的实验操作是___________________________________________。
②已知:常温下Fe(OH)3的Ksp=4.0×10-38。滤液的pH至少为________时,溶液中Fe3+开始沉淀。
(3)A溶液中主要含有的溶质是______________,验证溶质所含阳离子的方法是_____________。
(4)制备ZnO所焙烧的物质是含结晶水的碱式碳酸锌。取碱式碳酸锌6.82g,溶于HCl生成CO2 448 mL(标准状况下),溶解过程消耗HCl 0.12mol,若该碱式盐中氢元素的质量分数为1.76%,试推测该碱式碳酸锌的化学式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池电解硫酸钠饱和溶液的装置如图所示(a、b为铜电极)。下列说法中不正确的是( )
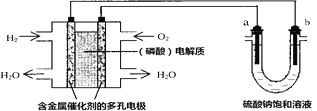
A. 电池工作时,正极反应式为:O2+4H++4e-=2H2O
B. 电解时,当阴极逸出a mol气体,同时有W克Na2SO410H2O 析出,保持温度不变,剩余溶中的硫酸钠的质量分数是![]()
C. 电解时,电子流动路径是:负极→外电路→阴极→阳极→正极
D. 若忽略能量损耗,当电池中消耗0.01mol O2 时,b 极周围会产生0.02mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容条件下,不能表明反应: 2NO2(g)![]() 2NO(g)+O2(g) 已达平衡状态的是
2NO(g)+O2(g) 已达平衡状态的是
A. 容器中颜色不再改变 B. 混合气平均相对分子质量不再改变
C. 混合气密度不再改变 D. 单位时间内生成n mol O2的同时生成2n mol NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列用来解释事实的方程式中不合理的是(已知:饱和NaClO溶液的pH约为11)
A. 该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-="==" Cl-+ ClO-+ H2O
B. 该消毒液的pH约为12:ClO-+ H2O![]() HClO+ OH-
HClO+ OH-
C. 该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++ Cl-+ ClO-= Cl2↑+H2O
D. 该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ ClO-= HClO+CH3COO—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com