
【题目】钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示。下列说法不正确的是
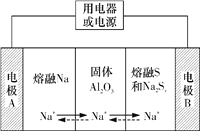
A. 放电时,电极A为负极,Na+由A极向B极移动
B. 该电池不能在常温下工作
C. 充电时,电极B连接外电源的负极
D. 放电时,B极的电极反应式为xS+2e-===S![]()
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
【题目】金晶体的最小重复单元(也称晶胞)是面心立方体,即在立方体的8个顶点各有一个金原子,各个面的中心有一个金原子,每个金原子被相邻的晶胞所共有(如图)。金原子的直径为d,用NA表示阿伏加德罗常数,M表示金的摩尔质量。

(1)金晶体每个晶胞中含有________个金原子。
(2)欲计算一个晶胞的体积,除假定金原子是刚性小球外,还应假定_______。
(3)一个晶胞的体积是多少?
(4)金晶体的密度是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学处理NOx、SO2等大气污染物,对改善人们的生存环境具有重要的现实意义。
(1)利用甲烷催化还原氮氧化物。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJmol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=-867kJmol-1
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=___kJmol-1。
(2)利用氧化氮氧化物的流程如下:
![]()
已知反应I的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,
若反应I中转移3mol电子,则反应Ⅱ中可生成N2的体积为_________L(标准状况下)。
(3)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离平衡_________(填“增大”、“减小”或“不变”);试计算溶液中c(SO32-)/c(HSO3-)=_______。(常温下H2SO3的电离常数:Ka1=1×10-2 mol/L,Ka2=6.0×10-8mol/L)
(4)利用Fe2(SO4)3溶液也可处理SO2废气,所得Fe2+溶液有很多重要用途。保存1.8mol·L-1的FeSO4溶液时,为防止溶液中Fe2+被氧化,常加入________;为确保溶液中不出现浑浊,应调节溶液的pH不超过______。(常温下,Ksp[Fe(OH)2]=1.8×10-16)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向足量H2SO4溶液中加入100 mL 0.4 mol·L-1Ba(OH)2溶液,放出的热量是5.12 kJ。如果向足量Ba(OH)2溶液中加入100 mL 0.4 mol·L-1盐酸时,放出的热量为2.2 kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为( )
A. Ba2+(aq)+SO42-(aq) =BaSO4(s)ΔH=-2.92 kJ·mol-1
B. Ba2+(aq)+SO42-(aq) =BaSO4(s)ΔH=-18 kJ·mol-1
C. Ba2+(aq)+SO42-(aq) =BaSO4(s)ΔH=-73 kJ·mol-1
D. Ba2+(aq)+SO42-(aq)=BaSO4(s)ΔH=-0.72 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0. 1000 mol·L-1的盐酸滴定20.00 mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示(饱和H2CO3溶液pH=5.6)。下列有关叙述正确的是
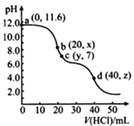
A. 若c(Na2CO3)=0.1000 mol·L-1,则H2CO3的Ka2数量级约为10-6
B. c点处溶液中一定有:c(Na+)=2c(CO32-)+c(HCO3-)
C. a、c两点水的c(OH-)之比为10-11.6 :10-7
D. 若z=5.6,则d点有c(Na+)=c(Cl-)>c(H2CO3)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4·2H2O)可抑制金属腐蚀。以钼精矿(主要成分为MoS2,含少量杂质)为原料,制备钼酸钠晶体的主要流程图如下。

回答下列问题
(1)完成下列反应:_____MoS2+ _____O2![]() _____SO2+ _____MoO3
_____SO2+ _____MoO3
在焙烧炉中,空气从炉底进入矿石经粉碎后从炉顶进入,这样处理的目的是__________________。
(2)浓氨水浸取粗产品获得(NH4)2MoO4溶液,其化学反应方程式为____________________________;该反应说明MoO3______(填“有”或“没有”)酸性氧化物的性质。
(3)常温下,沉钼阶段所得废液为(NH4)2SO4稀溶液。若(NH4)2SO4稀溶液的pH=a,则![]() =_______(用含a的代数式表示,NH3·H2O的Kb=1.8×10-5),若将此稀溶液蒸发浓缩,
=_______(用含a的代数式表示,NH3·H2O的Kb=1.8×10-5),若将此稀溶液蒸发浓缩,![]() 将_________(填“变大”“不变”或“变小”)。
将_________(填“变大”“不变”或“变小”)。
(4)已知钼酸钠在一定温度范围内的析出物质及相应物质的溶解度如下表所示,获得Na2MoO4·2H2O的操作为_____________。
温度(℃) | 0 | 4 | 9 | 10 | 15.5 | 32 | 51.5 | 100 |
析出物质 | Na2MoO4·10H2O | Na2MoO4·2H2O | ||||||
溶解度 | 30.63 | 33.85 | 38.16 | 39.28 | 39.27 | 39.82 | 41.27 | 45. |
结晶得到的母液可以在下次结晶时重复使用,但达到一定次数后必须净化处理,原因是_____________。
(5)空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4-Fe2O3保护膜,在密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入的物质是___________(填选项字母)。
A. NaNO2 B.通入适量N2 C.油脂 D.盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. 分子中含两个一CH3、分子式为C5H11Cl的同分异构体有3种
B. HNO3能与苯、甲苯、甘油、纤维素等有机物发生取代反应
C. 石油裂解的目的是为了提高轻质液体燃料的产量和质量
D. 有机物![]() 的一溴代物有4种
的一溴代物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种常用的化工原料,如合成氨和尿素[CO(NH2)2]等。
(1)以H2合成CO(NH2)2的有关热化学方程式有:
①N2(g)+3H2(g)===2NH3(g)ΔH1=-92.4 kJ·mol-1
②NH3(g)+![]() CO2(g)===
CO2(g)===![]() NH2CO2NH4(s)ΔH2=-79.7 kJ·mol-1
NH2CO2NH4(s)ΔH2=-79.7 kJ·mol-1
③NH2CO2NH4(s)===CO(NH2)2(s)+H2O(l)ΔH3=+72.5 kJ·mol-1
则N2(g)、H2(g)与CO2(g)反应生成CO(NH2)2(s)和H2O(l)的热化学方程式为_______________________________________________________。
(2)电解制H2的原理为C(s)+2H2O(l)![]() CO2(g)+2H2(g)。某学习小组拟以二甲醚(CH3OCH3)-空气碱性燃料电池为电源,电解煤浆液(由煤粉与稀硫酸组成)探究上述原理,装置如图所示。
CO2(g)+2H2(g)。某学习小组拟以二甲醚(CH3OCH3)-空气碱性燃料电池为电源,电解煤浆液(由煤粉与稀硫酸组成)探究上述原理,装置如图所示。
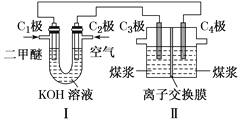
①分别写出电极C1和C3的电极反应式__________________;___________________。
②离子交换膜可能是________(填字母)。
a.阳离子交换膜 b.阴离子交换膜 c.质子交换膜
③已知4.6 g二甲醚参与反应,假设装置Ⅰ的能量转化率为100%,C4极收集到11.2L(标准状况)气体,装置Ⅱ的电流效率η=________。![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com