
【题目】某化学小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ:铜铝混合物 ![]() 测定生成气体的体积
测定生成气体的体积
方案Ⅱ:铜铝混合物 ![]() 测定剩余固体的质量
测定剩余固体的质量
下列有关判断中不正确的是( )
A.溶液A和B均可以是盐酸或NaOH溶液
B.若溶液B选用浓硝酸,则测得铜的质量分数偏小
C.溶液A和B均可选用稀硝酸
D.实验室中方案Ⅱ更便于实施
【答案】C
【解析】在常温下,铝既可溶于强酸,又可溶于强碱,且都产生H2 , 而铜则不能,铜只能溶于强氧化性酸,如与HNO3反应可产生NO2或NO,因此溶液A和B均可以是稀盐酸、稀硫酸或NaOH溶液,但不可选HNO3 , 故A项正确;若采用方案Ⅰ,由关系式2Al~3H2求出w(Al)进而求出w(Cu),若采用方案Ⅱ,铝溶解,而Cu不溶,则称量剩余固体质量即为m(Cu),显然测量固体质量较测定气体体积更易操作,便于实施,D选项正确;若溶液B选用HNO3 , 由于铝在浓硝酸中钝化,生成了致密的氧化膜,故所测得的固体质量实际上是铝和部分氧化铝的质量,此数据比混合物中铝的质量大,故得出的铜的质量偏小,w(Cu)偏小;溶液A选HNO3产生NO2或NO,气体不纯,不便计算。


科目:高中化学 来源: 题型:
【题目】下列反应中,属于加成反应的是( )
A. 乙烯使溴水褪色
B. 将苯滴入溴水中,振荡后水层接近无色
C. 乙烯使酸性KMnO4溶液褪色
D. 甲烷与Cl2混合,光照后黄绿色消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素在周期表中的位置,反映了元素的原子结构和元素的性质,下图是元素周期表的一部分:
(1)根据元素周期律,请你预测,H3AsO4、H3PO4的酸性强弱:H3AsO4H3PO4(填“>”、“<”或“=”).
(2)元素甲是第三周期金属元素中原子半径最小的元素,该元素的离子与过量氨水反应的离子方程式为: .
(3)周期表中有10多种人体所需的微量元素,其中有一种被誉为“生命元素”的主族元素R,对延长人类寿命起着重要作用.已知R元素的原子有4个电子层,其最高价氧化物的分子式为RO3 , 则R元素的名称为 .
A.硫
B.砷
C.硒
D.硅
(4)羰基硫(COS)分子结构与二氧化碳分子结构相似,所有原子的最外层都满足8电子结构,用电子式表示羰基硫分子的形成过程: . 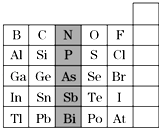
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀,若用如图所示实验装置可制得纯净的Fe(OH)2沉淀.两极材料分别为石墨和铁. 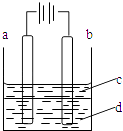
(1)a电极材料为 . 其电极反应式为 .
(2)电解液d可以是 , 则白色沉淀在电极上生成;也可以是 , 则白色沉淀在两极之间的溶液中生成.(填序号)
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)液体c为苯,其作用是 , 在加入苯之前,对d溶液进行加热煮沸处理的目的是 .
(4)为了在短时间内看到白色沉淀,可采取的措施是 . (填序号)
A.改用稀硫酸做电解液
B.适当增大电源电压
C.适当缩小两极间距离
D.适当降低电解液温度
(5)若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源,继续电解,除了电极上看到气泡外,另一明显现象为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A. 含有离子键的化合物一定是离子化合物
B. 含有共价键的化合物一定是共价化合物
C. 离子化合物中不可能含有共价键
D. 共价化合物中可能含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜和氯气都是用途广泛的化工原料。
(1)工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H+、Cl)制备碱式碳酸铜,其制备过程如下: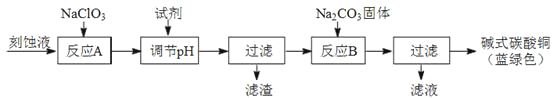
已知:Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
开始沉淀pH | 4.2 | 5.8 | 1.2 |
完全沉淀pH | 6.7 | 8.3 | 3.2 |
①氯酸钠的作用是;
②反应A后调节溶液的pH范围应为。
③第一次过滤得到的产品洗涤时,如何判断已经洗净?。
④造成蓝绿色产品中混有CuO杂质的原因是。
(2)某学习小组在实验室中利用下图所示装置制取氯气并探究其性质。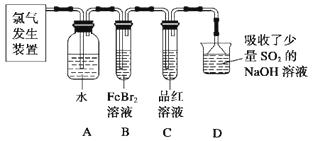
①实验室用二氧化锰和浓盐酸加热制取氯气,所用仪器需要检漏有。
②若C中品红溶液褪色,能否证明氯气与水反应的产物有漂白性,说明原因。此时B装置中发生反应的离子方程式是。
③写出A溶液中具有强氧化性微粒的化学式。若向A溶液中加入NaHCO3粉末,会观察到的现象是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G是一种医药中间体,常用于制备抗凝血药.可以通过如下所示的合成路线合成有机物G. 
已知:
①RCOOH ![]() RCOCl
RCOCl
②  +NaOH→
+NaOH→ ![]() +H2O
+H2O
请回答下列问题:
(1)写出A中官能团的名称: .
(2)D的结构简式: .
(3)写出B→C的化学反应方程式: .
(4)下列说法正确的是(填选项)
A.有机物G的分子式为C9H8O3
B.F能使酸性KMnO4溶液褪色
C.甲酸甲酯与C互为同分异构体
D.有机物A,B,C均能溶解于水.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子能大量共存的是( )
A.含大量H+的溶液中:CrO42-、Cl-、NO3-、Na+
B.含大量AlO2-的溶液中:Na+、K+、NO3-、HCO3-
C.含大量Al3+的溶液中:Na+、K+、NO3-、ClO-
D.含大量CH3COO-的溶液中:NH4+、Cl-、F-、K+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com