


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
| A、在一定温度下的饱和AgCl水溶液中,Ag+与Cl-的浓度乘积是一个常数 |
| B、已知AgCl的Ksp=1.8×10-10 mol2?L-2,则在任何含AgCl固体的溶液中,c(Ag+)=c(Cl-),且Ag+与Cl-浓度的乘积等于1.8×10-10 mol2?L-2 |
| C、Ksp数值越大的难溶电解质在水中的溶解能力越强 |
| D、难溶电解质的溶解程度很小,故外界条件改变,对它的溶解程度没有影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属腐蚀就是金属原子失去电子被还原的过程 |
| B、钢铁吸氧腐蚀时,负极反应式为:2H2O+O2+4e→4OH- |
| C、1.68g铁粉发生吸氧腐蚀时,理论上最多能吸收氧气504mL(标准状况) |
| D、镀锌铁皮的镀层损坏后,铁更容易腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
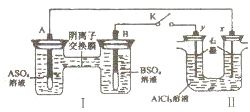 某同学按如图所示的装置进行试验.A、B两种常见金属,它们的硫酸盐可溶于水,当K闭合时,在交换膜处SO42-从右向左移动.下列说法错误的是( )
某同学按如图所示的装置进行试验.A、B两种常见金属,它们的硫酸盐可溶于水,当K闭合时,在交换膜处SO42-从右向左移动.下列说法错误的是( )| A、电解一段时间后,向Ⅱ装置通入适量的HCl气体可以恢复原来的浓度 |
| B、反应初期,y电极周围出现白色沉淀 |
| C、B电极质量增加 |
| D、x电极产生气泡,且生成1mol气体的同时,有1molA参与反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
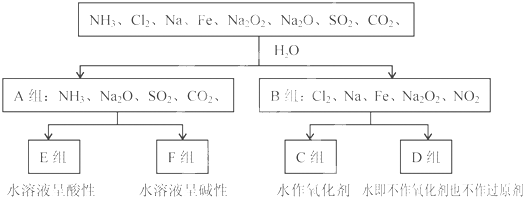
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、该反应的氧化剂是SiO2和 |
| B、该反应的还原产物为CO |
| C、该反应的本质是有化合价变化 |
| D、1mol N2参加反应转移6mole- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| A、HI>HCl>NH3 |
| B、HCl>NH3>HI |
| C、HCl>HI>NH3 |
| D、NH3>HI>HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com