
| A. | 用石灰石-石膏法可以消除燃煤烟气中的二氧化硫,同时还得到副产品石膏(CaSO3•2H2O)和亚硫酸铵 | |
| B. | 利用太阳能光电转化材料组装的器件,只要光电转化效率都达到10%,利用太阳投射到地球上能量的0.1%就能满足当前全世界能源需要 | |
| C. | 借助扫描隧道显微镜,能实现对原子或分子的操纵 | |
| D. | 道尔顿提出的原子学说、阿伦尼乌斯创立的电离学说、门捷列夫提出的元素周期律都对化学学科的发展作出了重要的贡献 |
分析 A.石膏为硫酸钙的结晶水合物,不是亚硫酸钙;
B.太阳投射到地球上的能量,是当前全世界能耗的一万倍,只要制作出太阳能光电转化材料组装的器件,就可以解决能源问题;
C.STM技术可实现对原子或分子的操纵;
D.原子学说、电离学说、元素周期律的提出科学家分别为道尔顿、阿伦尼乌斯和门捷列夫.
解答 解:A.石灰乳吸收烟气中的二氧化硫,生成亚硫酸钙,继续氧化可以得到石膏,所以还得到副产品石膏(CaSO4•2H2O)和亚硫酸铵,故A错误;
B.太阳投射到地球上的能量,是当前全世界能耗的一万倍,所以只要光电转化效率都达到10%,利用太阳投射到地球上能量的0.1%就能满足当前全世界能源需要,故B正确;
C.扫描隧道显微镜可观察到分子,应用STM技术可实现对原子或分子的操纵,故C正确;
D.原子学说、电离学说、元素周期律的提出科学家分别为道尔顿、阿伦尼乌斯和门捷列夫,他们都对化学学科的发展作出了重要的贡献,故D正确;
故选A.
点评 本题考查了二氧化硫的污染与治理、能源的开发与利用等知识,题目难度不大,注意掌握常见污染物的治理方法,了解化学发展史及新能源的开发与利用等知识.


科目:高中化学 来源: 题型:选择题
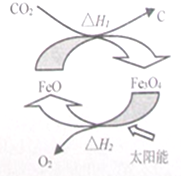 太阳能的开发与利用是能源领域的一个重要研究方向,由CO2制取C的太阳能工艺如图所示,下列有关说法正确的是(NA为阿伏伽德罗常数的值)( )
太阳能的开发与利用是能源领域的一个重要研究方向,由CO2制取C的太阳能工艺如图所示,下列有关说法正确的是(NA为阿伏伽德罗常数的值)( )| A. | 分解1molFe3O4转移电子数为2NA | |
| B. | 根据盖斯定律可知,△H1+△H2=0 | |
| C. | FeO在CO2转化为C的过程中的作用是催化剂 | |
| D. | CO2中σ键与π键个数之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用苯和溴水在铁作催化剂的条件下制备溴苯 | |
| B. | 向淀粉在酸性条件下水解的产物中加银氨溶液,水浴加热,检验葡萄糖的生成 | |
| C. | 在溴乙烷与NaOH溶液反应后的溶液中直接滴加硝酸银溶液来检验卤素的种类 | |
| D. | 用CuSO4溶液和过量NaOH溶液混合,然后加入几滴乙醛,加热,产生砖红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在2 min末的反应速率,用B表示是 0.3 mol/(L•min) | |
| B. | 用A表示的反应速率是0.4 mol/(L•min) | |
| C. | 若乙容器中也同时进行此反应,且相同时间段内用D表示的速率是0.2 mol/(L•min),则乙容器中反应速率更快 | |
| D. | 对甲容器升高温度,则正反应速率将减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 正极 | 负极 | 电解质溶液 | |
| A | Cu | Zn | HCl |
| B | Zn | Cu | CuSO4 |
| C | Cu | Zn | CuSO4 |
| D | Cu | Zn | ZnCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定有SO2 和NO | B. | 肯定没有N2、O2和NO2 | ||
| C. | 可能有Cl2和O2 | D. | 肯定只有NO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 我国国家标准( GB2760 )规定葡萄酒中SO2最大使用量为0.25g•L-1.某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定.
我国国家标准( GB2760 )规定葡萄酒中SO2最大使用量为0.25g•L-1.某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com