
【题目】煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分。
(1)已知H2(g)、CO(g)和CH3OH(l)的标准燃烧热分别为-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5 kJ·mol-1。请写出CH3OH(l)完全燃烧生成二氧化碳和液态水的热化学方程式:________________________________________________________________。
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) ΔH。下表所列数据是该反应在不同温度下的化学平衡常数(K)
CH3OH(g) ΔH。下表所列数据是该反应在不同温度下的化学平衡常数(K)
温度/℃ | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判断ΔH________(填“>”、“=”或“<”)0。
②某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应后,4 min达到平衡时测得c(CO)=0.2 mol·L-1,此时的温度为_____,则反应速率v(H2)=__________。
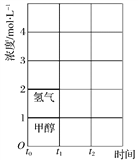
(3)T ℃时,在t0时刻,合成甲醇反应CO(g)+2H2(g)![]() CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小为原来的
CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小为原来的![]() ,在t2时刻又达到新的平衡,请在图中用曲线表示t1~t2时间段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其他条件不变,曲线上必须标明氢气、甲醇)。__________
,在t2时刻又达到新的平衡,请在图中用曲线表示t1~t2时间段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其他条件不变,曲线上必须标明氢气、甲醇)。__________
(4)如果用CH3OH和空气作燃料电池,用KOH作电解质溶液,请写出该燃料电池的负极的电极反应式:_____________________________________________________。
【答案】 CH3OH(l)+![]() O2(g)===CO2(g)+2H2O(l) ΔH=-726.5 kJ·mol-1 < 250 ℃ 0.4 mol·L-1·min-1
O2(g)===CO2(g)+2H2O(l) ΔH=-726.5 kJ·mol-1 < 250 ℃ 0.4 mol·L-1·min-1  CH3OH-6e-+8OH-===CO
CH3OH-6e-+8OH-===CO![]() +6H2O
+6H2O
【解析】(1)CH3OH(l)的燃烧热为726.5kJmol-1,则甲醇完全燃烧的热化学方程式为CH3OH(l)+![]() O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJmol-1;
O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJmol-1;
(2)①升高温度,平衡向吸热方向移动,根据表格知,温度越高,化学平衡常数越小,说明平衡向逆反应方向移动,所以正反应是放热反应,即△H<0;
② CO(g)+2H2(g)CH3OH(g)
反应开始 1mol/L 3mol/L 0
反应 0.8mol/L 1.6mol/L 0.8mol/L
平衡 0.2mol/L 1.4mol/L 0.8mol/L
平衡常数K=![]() =2.04,所以是250℃;反应速率v(H2)=
=2.04,所以是250℃;反应速率v(H2)=![]() =0.4 molL-1min-1;
=0.4 molL-1min-1;
(3)若在t1时刻将容器的体积缩小一倍,相当于增大压强,各组分的浓度立即增加原来的一倍,然后是平衡开始正向移动,至新平衡,图示如下:
假定在t2时刻后又达到新的平衡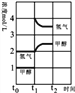 ;
;
(4)CH3OH和空气作燃料电池,负极CH3OH发生氧化反应,在碱性条件下的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 手性异构体性质相同 B. 互为手性异构体的分子互为镜像
C. 手性异构体分子组成相同 D. 手性催化剂只催化或主要催化一种手性分子的合成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向甲、乙两个容积均为1 L的恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B。相同温度下发生反应:A(g)+B(g) ![]() xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示。下列说法正确的是( )
xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示。下列说法正确的是( )


A. x可能等于1
B. 甲、乙两容器中反应达平衡时,平衡常数K甲<K乙
C. 将乙容器升温可使甲、乙容器内各物质的体积分数相同
D. 若向甲容器中再充入2 mol A、2 mol B,则平衡时甲容器中0.78 mol·L-1<c(A)<1.56 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质分类或归类正确的是
A. 液氯、水玻璃均为混合物 B. 液氨、干冰均为化合物
C. 醋酸、P2O5均为电解质 D. Na2O2、Na2SiO3均为钠盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱等的原料。
(1)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2+3H2![]() 2NH3。该可逆反应达到平衡的标志是________________。
2NH3。该可逆反应达到平衡的标志是________________。
A.3v(H2)正=2v(NH3)逆
B.单位时间生成m mol N2的同时消耗3m mol H2
C.容器内的总压强不再随时间而变化
D.混合气体的密度不再随时间变化
E.a molN≡N键断裂的同时,有6amolN—H键断裂
F.N2、H2、NH3的分子数之比为1∶3∶2
(2)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入1molN2和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
则从反应开始到25min时,以N2表示的平均反应速率= ;该温度下平衡常数K= ;
(3) 利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H=-99kJ·mol-1
CH3OH(g) △H=-99kJ·mol-1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-58 kJ·mol-1
CH3OH(g)+H2O(g) △H=-58 kJ·mol-1
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H
CO(g)+H2O(g) △H
图1中能正确反映平衡常数K随温度变化关系的曲线是 ;反应③的△H= kJ·mol-1。
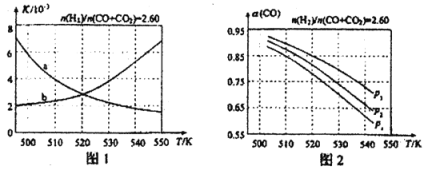
(4)合成气的组成n(2)/n(CO+CO2)=2.60时体系中的CO平衡转化率α(CO)与温度和压强的关系如图2所示。图中的压强p1、p2、p3由大到小的顺序为 ;α(CO)随温度升高而减小,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各溶液中,离子一定能大量共存的是
A. 强碱性溶液中:K+、AlO2-、Cl-、SO42-
B. 强酸性溶液中:K+、SO42-、Fe2+、NO3-
C. 与铝反应产生大量氢气的溶液中:Na+、CO32-、NO3-、K+
D. 某无色溶液中:Fe3+、Cl-、Na+、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 石灰乳与过量碳酸氢钙溶液反应:HCO+Ca2++OH-===CaCO3↓+H2O
B. 向沸水中滴加饱和的FeCl3溶液制备Fe(OH)3胶体:
FeCl3+3H2O(沸水)![]() Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl
C. 氢氧化铜与稀硫酸反应:H++OH-===H2O
D. 碳酸氢钠溶液中加入盐酸:CO32-+2H+===CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某厂从废催化剂(主要含Pt、Al2O3、石墨等)中回收海绵铂和硫酸铝晶体。工艺流程如下:
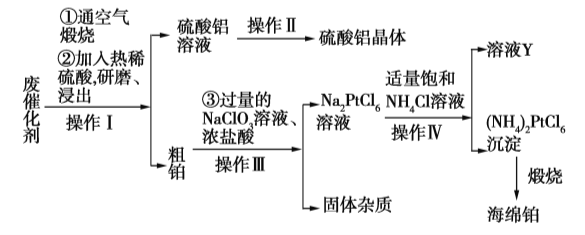
请回答下列问题:
(1)第①步通入空气煅烧的目的是_____________________________。
(2)第②步用热酸研磨浸出而不是直接浸出的原因是_____________________________。
(3)写出第③步反应的离子方程式:_____________________________。
(4)此流程中的四个操作中有三个是相同的,其名称是__________,在实验室进行此操作使用的主要玻璃仪器有___________________。溶液Y中可以循环使用的物质是____________(填化学式)。
(5)用返滴定法测定硫酸铝晶体中铝的含量:称取硫酸铝晶体0.5400 g,用2.0 mL 3.0 mol·L1的硫酸溶解后制成250 mL溶液,取25.00 mL于锥形瓶中,加入0.02 mol·L1的EDTA标准液20.00 mL和缓冲溶液,加热5 min,冷却至室温,加2滴二甲酚橙指示剂,用0.02 mol·L1的标准ZnSO4溶液滴定至终点消耗5.00 mL。则该晶体中铝的质量分数为___________。(已知Al3+、Zn2+与EDTA反应的方程式如下:Al3++H2Y2![]() AlY+2H+,H2Y2+Zn2+
AlY+2H+,H2Y2+Zn2+![]() ZnY2+2H+)
ZnY2+2H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com